Manuel Hevia1, Esther García Rojo2
1. Hospital Universitario Ramón y Cajal. Madrid
2. Hospital universitario HM Sanchinarro y Roc Clinic.
1. Introducción
El cáncer de pene es una forma poco común de neoplasia epitelial en nuestro medio (1). La mayoría de los casos de cáncer invasivo en el pene son atribuibles al carcinoma de células escamosas, que representa aproximadamente el 95% de los casos y se origina en el epitelio de la parte interna del glande y/o del prepucio (2). Este tipo de cáncer, a pesar de su baja incidencia, conlleva importantes implicaciones tanto físicas como psicológicas para quienes lo padecen. Su desarrollo y características patológicas son similares a las de otros tipos de cánceres epiteliales, como los que afectan la bucofaringe, el cuello uterino, la vagina, la vulva y el ano (3).
El conocimiento cada vez más completo sobre la progresión de esta enfermedad y los avances en el diagnóstico temprano han contribuido significativamente a mejorar las tasas de curación de este cáncer.
2. Epidemiologia
La incidencia de cáncer de pene muestra una marcada variación entre distintos países, siendo las naciones menos desarrolladas las que presentan las tasas más elevadas. En lugares como Estados Unidos, Canadá y países europeos, el cáncer de pene constituye aproximadamente el 0,4% al 0,6% de todos los tipos de cáncer en hombres(4).
3. Factores de riesgo
Los factores de riesgo para el cáncer de pene incluyen (5–7):
- Edad
- Fimosis: Un alto porcentaje de pacientes con cáncer de pene tiene fimosis.
- Infección por VPH: El VPH, en particular los tipos 16, 18, 6 y 11, aumenta el riesgo. La mayor prevalencia de HPV está relacionada con el tipo histológico basaloide (72,5%) y papilar (15%), no está presente o es muy inusual en los tipos verrucoso, pseudohiperplástico y pseudoglandular (8)
- Tabaquismo: Fumar, especialmente en grandes cantidades y durante muchos años, incrementa el riesgo.
- Lesiones en el pene y balanitis crónicas: Historia de laceraciones y balanitis crónica están relacionadas con un mayor riesgo.
- Lesiones premalignas: Condiciones como eritroplasia de Queyrat, enfermedad de Bowen, papulosis bowenoide y condiloma acuminado gigante pueden transformarse en cáncer de pene en algunos casos (9).
- Liquen escleroso: Esta condición de la piel del prepucio y glande se asocia con un riesgo de cáncer de pene(10).
- Verrugas genitales: La presencia de verrugas genitales aumenta el riesgo de cáncer de pene.
4. Patología
El carcinoma epidermoide (CE) representa el 95% de las lesiones malignas del pene. Habitualmente se origina en la mucosa del prepucio, el glande y el surco balano-prepucial, y con menos frecuencia se sitúa en el cuerpo peneano.
Otros tumores menos frecuentes son melanomas, linfomas, sarcomas, tumores mesenquimales y metástasis.
Existen distintas variantes histológicas de CE de pene con diferentes patrones de crecimiento y agresividad. Algunos de estos subtipos histológicos están relacionados con la infección por el virus del papiloma humano (VPH) (Tabla 1) (11–13)
Tabla 1. Subtipos histológicos del cáncer de pene (11–13)
|
Tipo histológico |
Frecuencia (%) |
Mortalidad (%) |
|
Independiente de VPH |
||
|
Usual |
45-75 |
20-38 |
|
Pseudohiperplásico |
<1 |
0 |
|
Pseudoglandular |
<1 |
30 |
|
Verrucoso |
3-8 |
0 |
|
Cuniculatum |
<1 |
0 |
|
Papilar |
2-15 |
0-6 |
|
Sarcomatoide |
1-7 |
45-90 |
|
Mixto |
10-19 |
3-7 |
|
Asociado a VPH |
||
|
Basaloide |
4-10 |
21-67 |
|
Verrucoso |
5-10 |
0-10 |
|
Células claras |
<1 |
20-30 |
|
Linfoepiteliom-like |
<1 |
Unknown |
|
Mixto |
4-10 |
3-50 |
Consideraciones anatomopatológicas
En caso de duda acerca del diagnóstico (melanoma, metástasis) se debe realizar una biopsia, preferiblemente excisional dado que permite evaluar mejor la profundidad en comparación con la biopsia con aguja.
La exéresis quirúrgica de la lesión determina la precisión del diagnóstico histológico, por ello la muestra debe ser orientada adecuadamente por el cirujano marcando ciertos puntos de referencia que permitan la evaluación de los márgenes de resección.
Los tumores de menor tamaño deben incluirse en bloque mientras que las lesiones mas grandes se incluyen en 3 o 4 bloques con las referencias anatómicas correspondientes. (14). Las piezas de linfadenectomía deben examinarse rigurosamente ya que la presencia de extensión extracapsular condiciona la estadificación y las decisiones de tratamiento posteriores.
El informe anatomopatológico debe incluir el tipo histológico, grado de agresividad, presencia de invasión perineural, vascular o linfática, invasión del cuerpo cavernoso o esponjoso, márgenes e inhumohistoquímica de p16 si (15).
El subtipo histológico, la invasión perineural y linfovascular, la profundidad de invasión y el grado de malignidad son factores de mal pronóstico y de alta mortalidad cáncer específica (16,17). La afectación del cuerpo esponjoso no es considerado un factor pronóstico (18).
Cáncer de pene y VPH
Según la clasificación de la WHO la presencia de VPH es un factor importante, aunque en la mayoría de los centros no se dispone de una evaluación molecular del VPH.
La inmunohistoquímica de p16 se utiliza en sustitución del examen molecular. Se observo positividad para p16 en el 85% de carcinomas asociados a VPH en comparación con carcinomas no relacionados con VPH (19).
TNM y grupos pronósticos
Tabla 2. Clasificación TNM clínica y patológica para el cáncer de pene (20,21)
|
CLASIFICIACIÓN CLÍNICA |
|
T- TUMOR PRIMARIO |
|
TX: El tumor primario no se puede evaluar T0: sin evidencia de tumor Tis: carcinoma in situ (neoplastia intrapeitelial peneana) Ta: Carcinoma no invasor T1: El tumor invade el tejido conjuntivo subepitelial
T2: El tumor invade el cuerpo esponjoso con o sin invasión de la uretra T3: El tumor invade el cuerpo cavernoso con o sin invasión de la uretra T4: El tumor invade estructuras adyacentes |
|
N-GANGLIOS LINFÁTICOS |
|
cNX: los ganglios linfáticos no se pueden evaluar cN0: sin ganglios palpables o visibles cN1: ganglio unilateral palpable y móvil cN2: ganglios palpables móviles bilaterales o múltiples cN3: masa ganglionar inguinal fija o ganglios pélvicos uni o bilaterales |
|
M-METÁSTASIS A DISTANCIA |
|
cM0: no metástasis a distancia cM1: metástasis a distancia |
|
CLASIFICACIÓN PATOLÓGICA |
|
pN-GANGLIOS LINFÁTICOS (biopsia o escisión quirúrgica) |
|
pNX: los ganglios linfáticos no se pueden evaluar pN0: no metástasis ganglionares pN1: metástasis en 1 ó 2 ganglios linfáticos pN2: metástasis en más de 2 ganglios inguinales unilaterales o metástasis inguinal bilateral pN3: metástasis en ganglios linfáticos pélvicos, unilateral o bilateral o extensión extracapsular en ganglios linfáticos regionales |
|
pM-METÁSTASIS A DISTANCIA |
|
pM1: metástasis a distancia confirmadas microscópicamente |
|
G: GRADO HISTOPATOLÓGICO |
|
GX: el grado de diferenciación no se puede evaluar G1: bien diferenciado G2: moderadamente diferenciado G3: pobremente diferenciado G4: indiferenciado |
Tabla 3. Grupos pronósticos (20)
|
ESTADIO |
T |
N |
M |
|
0 |
Tis Ta |
N0 N0 |
M0 M0 |
|
I |
T1a |
N0 |
M0 |
|
IIA |
T1b T2 |
N0 N0 |
M0 M0 |
|
IIB |
T3 |
N0 |
M0 |
|
IIIA |
T1-3 |
N1 |
M0 |
|
IIIB |
T1-3 |
N2 |
M0 |
|
IV |
T4 Cualquier T Cualquier T |
Cualquier N N3 Cualquier N |
M0 M0 M1 |
5. Historia natural
El cáncer de pene tiende a manifestarse con mayor frecuencia en el glande y el prepucio. Muchas veces los pacientes demoran en buscar atención médica, lo que significa que alrededor del 25% al 50% de ellos ya presentan lesiones con un año de evolución al momento de ser diagnosticados (22).
La fascia de Buck, una estructura que rodea el pene, actúa como una barrera natural para limitar la propagación del tumor en el área local. Sin embargo, si esta barrera se rompe, el cáncer puede penetrar en los cuerpos cavernosos del pene y luego diseminarse a través del sistema linfático. El sistema linfático del pene incluye ganglios linfáticos inguinales superficiales y profundos, y más tarde, ganglios linfáticos en la pelvis.
La infiltración de los ganglios linfáticos inguinales superficiales puede llevar a la formación de úlceras e infecciones en la piel, mientras que la infiltración de los ganglios linfáticos profundos puede comprometer los vasos sanguíneos femorales, lo que puede resultar en hemorragias graves.
Los pacientes con cáncer de pene no tratado tienden a tener un pronóstico sombrío, y muchos fallecen dentro de los 2 años posteriores al diagnóstico. Esto suele ocurrir debido a complicaciones derivadas del crecimiento incontrolado de la enfermedad en el área local o a la aparición de metástasis a distancia. Es importante destacar que las metástasis a distancia sin afectación local son raras en esta enfermedad. Por lo tanto, el diagnóstico temprano y el tratamiento adecuado son cruciales para mejorar las perspectivas de los pacientes con cáncer de pene.
6. Diagnóstico
Lesión primaria
a) Examen físico: el carcinoma primario de pene se suele manifestar con una lesión clínicamente evidente habitualmente sobreelevada o ulcerada. Esta última forma de presentación suele producir mayor afectación local e invasión de los tejidos (23).
En ocasiones el tumor puede quedar oculto bajo la piel prepucial por lo que es necesario retraer dicha piel para una correcta evaluación, así como la palpación de todo el cuerpo del pene. Es importante tener en cuenta la ubicación anatómica, el grado de invasión local y la longitud del pene (14).
b) Pruebas de imagen: en los tumores confinados al pene el examen físico es un método fiable para valorar la extensión del tumor y el estadio clínico T (24).
La resonancia magnética puede ser útil en casos de cirugía conservadora o para valorar la invasión del cuerpo cavernoso (25,26).
En casos de tumor localmente avanzados la resonancia magnética proporciona información importante sobre la invasión de estructuras vecinas y posible exéresis quirúrgica.
c) Biopsia de pene: se debe realizar la biopsia de pene cuando existan dudas acerca de la naturaleza de la lesión. También es necesaria cuando se plantean tratamientos con agentes tópicos, radioterapia o cirugía láser (23).
Ganglios linfáticos
La detección precoz de metástasis ganglionares es crucial para el control de la enfermedad. El cáncer de pene metastatiza de manera gradual afectando inicialmente a los ganglios inguinales, posteriormente a los pelvianos y a los ganglios más distantes (27). Menos del 5% de os pacientes presentan metástasis al momento del diagnóstico y estos habitualmente presentan enfermedad ganglionar local.
El factor pronóstico más importante de supervivencia en el cáncer de pene es la presencia de metástasis ganglionares siendo de 95% para N0, 80% para N1, 65% para N2 y 35% para N3 (28,29).
La exploración de ambas zonas inguinales en busca de ganglios palpables debe ser parte del examen físico inicial. Este puede resultar especialmente difícil en obesos o pacientes con cirugía inguinal previa.
Al momento del diagnóstico los ganglios palpables pueden ser reactivos al proceso inflamatorio o infeccioso mientras que durante el seguimiento sugieren la presencia de metástasis. Para una correcta estadificación es necesario describir el número, la ubicación, el tamaño y si es móvil o fijo.
a) Pacientes con ganglios no palpables (cN0)
En pacientes con ganglios no palpables hasta el 20-25% pueden tener metástasis ocultas (30).
- Opciones de estadificación no quirúrgicas: no existen nomogramas que puedan predecir de manera fiable la afectación de los ganglios linfáticos. Las pruebas de imagen como la ecografía, la tomografía computarizada (TC) o la resonancia magnética no son capaces de detectar micrometástasis. La tomografía por emisión de positrones con 18F-fluoro-2-desoxi-D-glucosa (18 FDG-PET) no es capaz de detectar metástasis en nódulos menores a 10 mm (31–33)
En centros que practican la biopsia selectiva de ganglio centinela se realiza previamente una ecografía. Si se detectan ganglios sospechosos ecográficamente se puede realizar en el mismo acto una punción-aspiración con aguja fina (PAAF) para confirmar el diagnóstico de metástasis (34).
Si la PAAF es positiva se puede reducir la necesidad de biopsia selectiva de ganglio centinela hasta en un 10-13% (35,36) .
Por lo tanto, se recomienda realizar una ecografía + PAAF en pacientes con ganglios no palpables antes de la estadificación quirúrgica mediante la biopsia de ganglio centinela.
- Opciones de estadficación quirúrgicas: la estadificación quirúrgica supone un tratamiento excesivo para la mayoría de los pacientes dado que únicamente el 20-25% de los casos de ganglios no palpables albergan metástasis.
Existen categorías de riesgo basadas en el estadio T, el grado de diferenciación y la presencia de invasión linfovascular o perineural. Los tumores bien diferenciados (G1), pTa, PTis y pT1 se consideran tumores de bajo riesgo. En dichos pacientes el riesgo de metástasis es demasiado bajo para justificar la linfadenectomía diagnóstica. Los tumores pT1a moderadamente diferenciados (G2) se consideran de riesgo intermedio y se asocian con una incidencia de micrometástasis del 6-8%, mientras que los tumores pT1b G2 la probabilidad de micrometástasis es del 22-30%. Por lo tanto, todos los tumores de estadio pT1b o superior se consideran tumores de alto riesgo (37,38).
Con base en esta categorización se recomienda la estadificación quirúrgica en todos los tumores de alto riesgo. En los casos de riesgo intermedio se debe individualizar la estrategia diagnóstica en función de la comorbilidad.
La linfadenectomía radical de las cadenas ganglionares inguinales es el método de estadificación quirúrgico mas preciso sin embargo se asocia con tasas de complicaciones mas altas. Para ello se han diseñado diferentes esquemas de linfadenectomía modificada.
La introducción de la cirugía endoscópica ha permitido llevar a cabo una linfadenectomía con menos tasas de complicación en relación con la herida en comparación con la abierta (39).
Para evitar la resección innecesaria de ganglios linfáticos y minimizar así la morbilidad de la estadificación quirúrgica se desarrollo la biopsia selectiva de ganglio centinela (40). El ganglio centinela se define como el primer ganglio de una cadena linfática que drena el territorio del tumor. Basándonos en dicho concepto suponemos que si el ganglio centinela es negativo no existe diseminación linfática. En caso de micrometástasis del ganglio centinela se debe realizar la linfadenectomía inguinal radical ipsilateral (41)
Generalmente la biopsia dinámica se realiza mediante la inyección de un trazador radioactivo y un tinte azul para lograr una visualización óptima del sistema de drenaje linfático antes y durante la cirugía. En centros de alta experiencia este procedimiento tiene una sensibilidad diagnostica del 92-96% con tasas de falsos negativos del 4-8% (36,42,43).
Si la biopsia de ganglio centinela no esta disponible se puede considerar la linfadenectomía inguinal modificada preferiblemente endoscópica.
b) Pacientes con ganglios palpables (cN+)
En pacientes con ganglios palpables las metástasis ganglonares están presentes en aproximadamente el 45-80% de los casos (44). Es conveniente la confirmación histopatológica mediante biopsia guiada por ecografía o TC. El estudio de extensión en pacientes con ganglios palpables es importante para la detección de metástasis ganglionares pelvianas o a distancia aunque la tasa de detección se sitúa en torno al 20-38% (14). Las tasas de detección de la TC y la resonancia magnética son equiparables (45).
El PET-TC muestra una sensibilidad y especificidad de 91% y 100% respectivamente para la detección de metástasis ganglionares pélvicas en pacientes con enfermedad ganglionar inguinal confirmada por ecografía y PAAF (46)
7. Tratamiento local del tumor primario
Para el manejo del cáncer de pene, la intervención quirúrgica es una parte fundamental tanto en el diagnóstico como en la gestión primaria de la enfermedad. Esto es crucial para una adecuada estadificación inicial y para determinar las estrategias relacionadas con los ganglios linfáticos inguinales y pélvicos. El objetivo primordial de la cirugía es la extirpación completa del tumor primario con márgenes adecuados, al mismo tiempo que se busca preservar la continencia urinaria y la función sexual en la medida de lo posible.
Se reconoce que la demora o la realización incompleta de los procedimientos quirúrgicos tienen un impacto significativo en la supervivencia del paciente. La progresión local del cáncer se caracteriza por la presencia de metástasis ganglionares en la región inguinal, lo que puede llevar a complicaciones desafiantes como ulceración, fístulas y linfangitis.
En el tratamiento del tumor primario, la elección de la modalidad terapéutica depende de la estadificación clínica. Sin embargo, es importante señalar que hasta la fecha, existe una limitada evidencia científica en estudios comparativos entre terapias ablativas y cirugía conservadora para la enfermedad localizada(47).
La preservación del pene se considera una prioridad en el tratamiento del cáncer de pene. A pesar de la falta de ensayos clínicos aleatorizados que comparen diferentes opciones de tratamiento, la preservación del pene se ha asociado con mejores resultados funcionales y cosméticos en comparación con la penectomía parcial o total, basándose en estudios retrospectivos y la opinión de expertos(48). Histológicamente, la confirmación del diagnóstico y la estadificación local son pasos fundamentales antes de considerar tratamientos no quirúrgicos.
En resumen, la cirugía desempeña un papel crucial en el manejo del cáncer de pene, y se busca lograr la extirpación completa del tumor mientras se preserva la función del órgano y la calidad de vida del paciente, aunque la elección entre diferentes enfoques terapéuticos puede variar según la estadificación y la falta de evidencia comparativa sólida.
Lesiones superficiales (pTa/PEIN)
El tratamiento de las lesiones superficiales y neoplasia Intraepitelial de Pene (PeIN) presenta desafíos clínicos, ya que esta entidad puede progresar a lesiones invasivas en un porcentaje significativo de pacientes (2.6-13%) (49). La erradicación completa y el seguimiento continuo son esenciales en su manejo.
Circuncisión: Pilar de la Terapia Primaria
La circuncisión o la extirpación quirúrgica del prepucio, se erige como el enfoque inicial en la mayoría de los casos de PeIN(49). Esto se debe a que la mayoría de las lesiones se encuentran en las superficies mucosas del glande o el prepucio. La circuncisión no solo permite el acceso a las lesiones sino que también induce la queratinización de la mucosa glandular. Esta queratinización puede resultar en la resolución de PeIN residual o liquen escleroso. Sin embargo, es importante destacar que se necesita una mayor investigación para respaldar esta observación clínica.
Terapias Tópicas: Imiquimod y 5-Fluorouracilo
Las terapias tópicas, como el imiquimod (IQ) y el 5-fluorouracilo (5-FU), se han convertido en opciones efectivas para el tratamiento de PeIN (50). No existe un protocolo estándar para su administración, pero se ha sugerido aplicar 5-FU durante 12 horas cada 48 horas durante un período de 4 a 6 semanas, o utilizar IQ tres veces por semana durante 12 semanas. Estas terapias han demostrado tasas variables de respuesta y recurrencia (40–100% y 20% para IQ, vs. 48–74% y 11% para 5-FU) (51) . Sin embargo, es importante tener en cuenta que los efectos secundarios pueden afectar la adherencia al tratamiento.
Ablación con Láser: Una Alternativa Valiosa
La ablación con láser, utilizando láser de CO2 o Nd:YAG (neodimio: itrio-aluminio-granate), representa una alternativa valiosa en el tratamiento de las lesiones superficiales. Aunque puede lograr tasas de respuesta total de hasta el 100%, las recurrencias se han informado en el 7-48% de los pacientes (51). Además, la ablación láser puede influir en la sensibilidad del pene, lo que hace que su uso requiera un monitoreo cuidadoso.
Cirugía
Cirugía de Resección y Procedimientos de Resurfacing
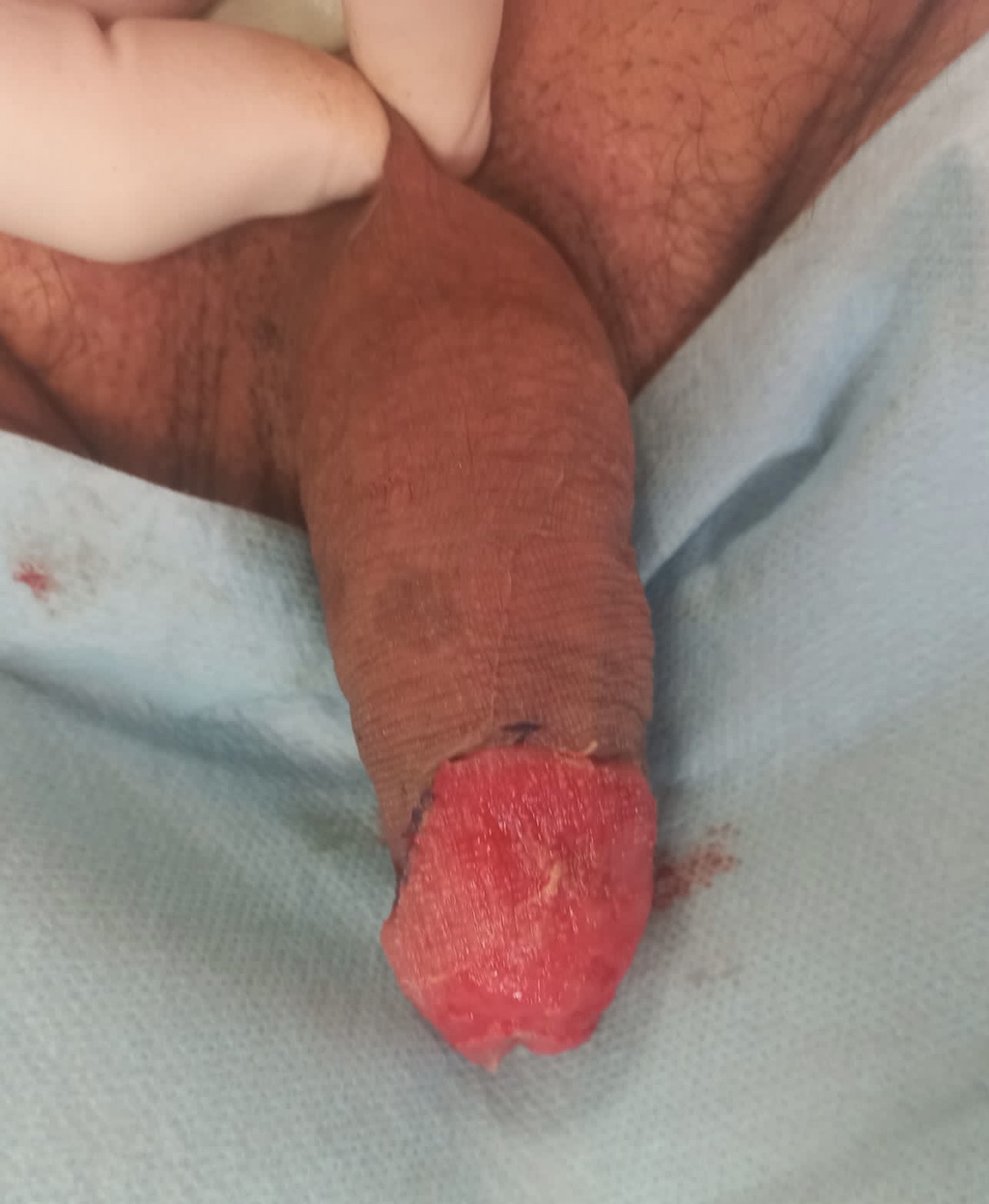
La cirugía de resección se contempla en casos de PeIN extenso, o cuando las terapias ablativas o tópicas no surten efecto. Un procedimiento emergente conocido como «resurfacing» implica la extirpación completa del epitelio glandular del pene, seguido de la reconstrucción con un injerto de piel parcial (52). A pesar de que en algunos casos se han detectado márgenes positivos, la recurrencia local es baja(52). Además, este enfoque permite un análisis histopatológico completo, lo que facilita la detección de áreas invasivas.
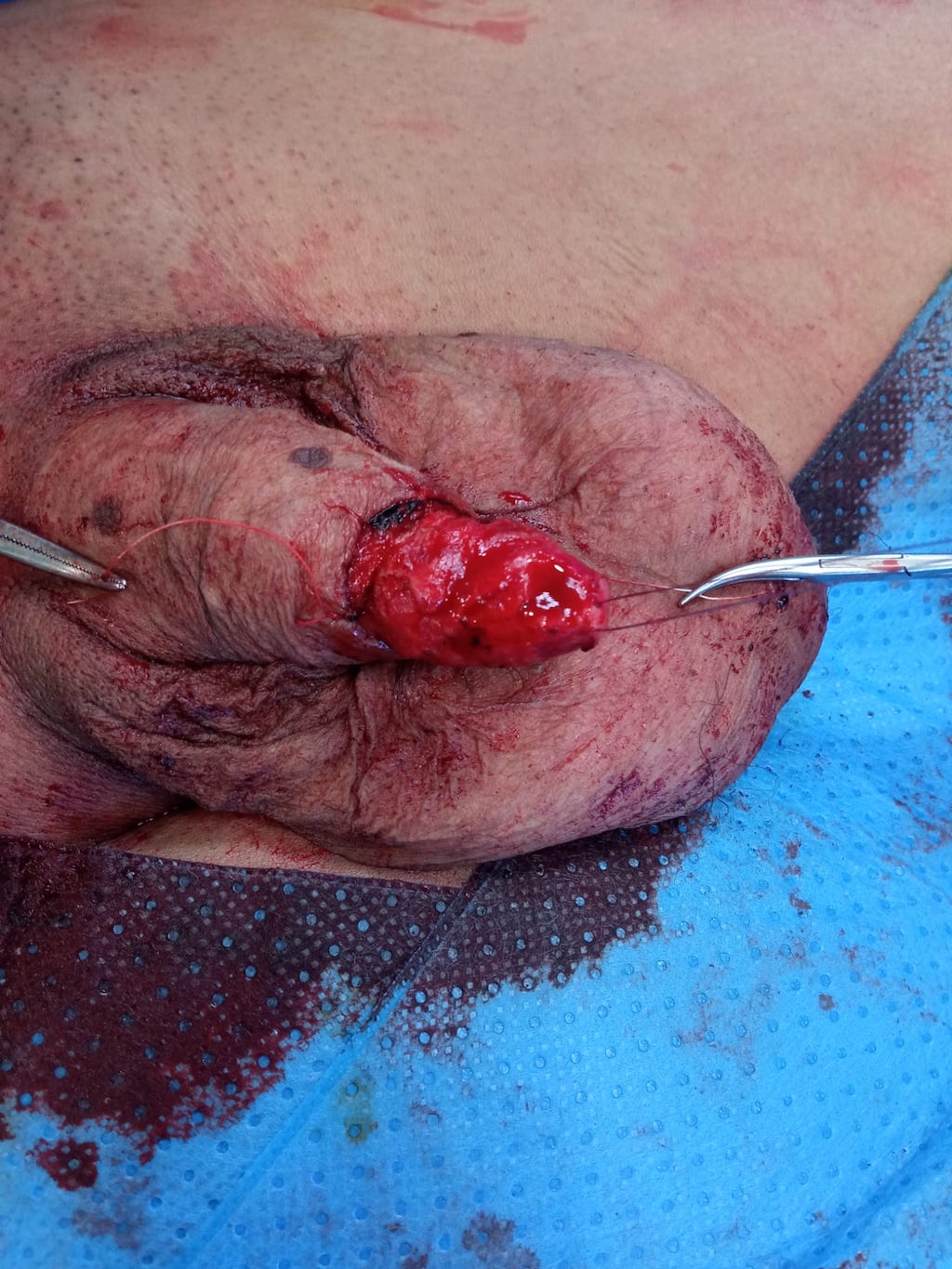
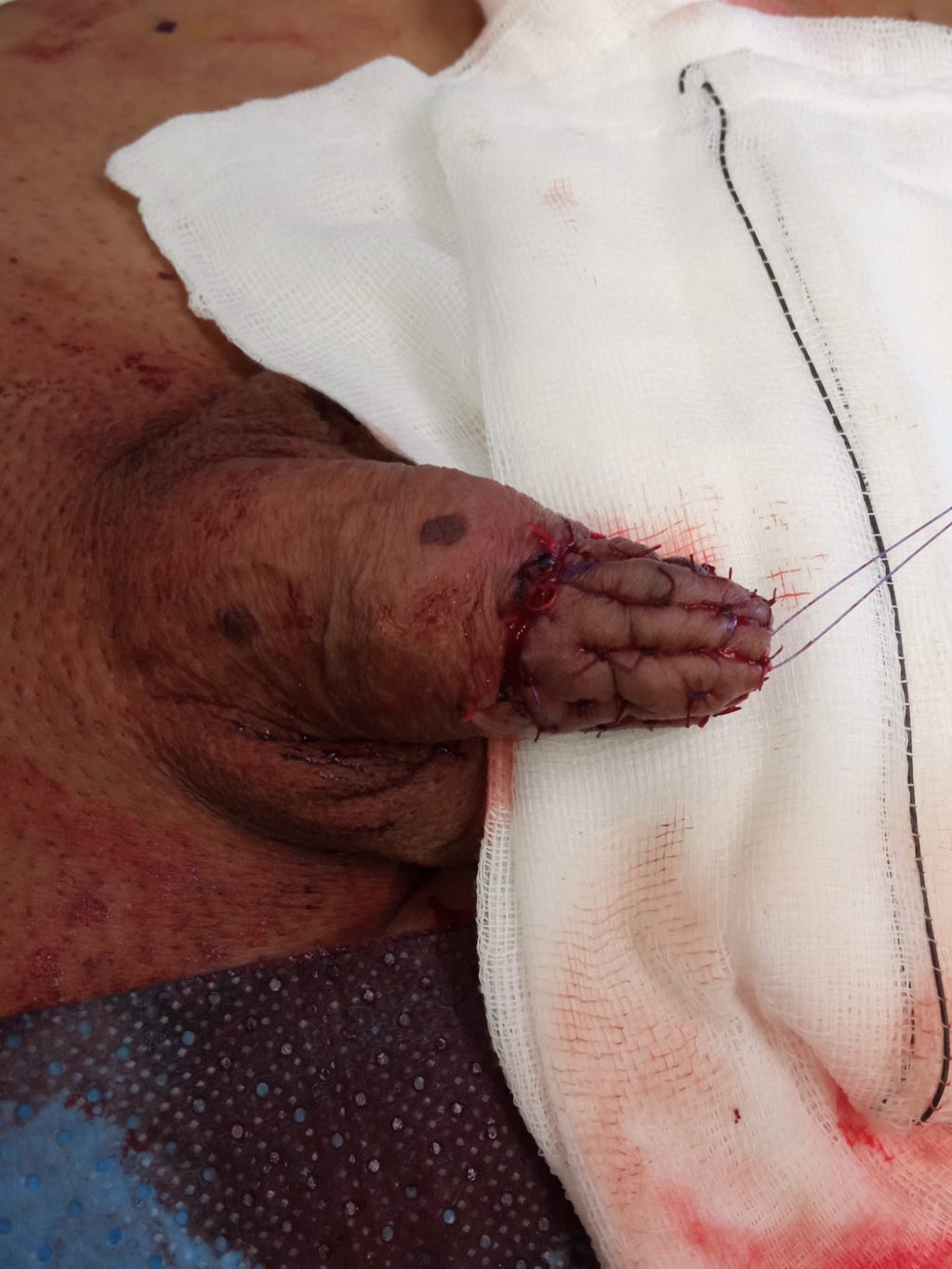
FOTOS:
RESURFACING Y RECONSTRUCCIÓN INJERTO CUTÁNEO.
CORTESÍA DR. AGUSTÍN FRAILE. H.U. RAMÓN Y CAJAL
Enfermedad invasora cT1/T2
El tratamiento de lesiones invasoras, especialmente las clasificadas como T1/T2, se basa en una evaluación de su tamaño, ubicación, grado histológico y las preferencias del paciente. No obstante, siempre que sea viable, se buscará la opción de llevar a cabo una cirugía conservadora que permita la preservación del pene. La resección de las lesiones en el glande y el prepucio suele requerir una circuncisión complementaria.
Cirugía Conservadora: Preservando el Órgano
Cuando es posible, se busca una estrategia de tratamiento que preserve el pene. La resección del tumor primario no solo erradica todas las células cancerosas en tumores localizados, sino que también proporciona una estadificación patológica definitiva sin el riesgo de sub-estadificación que se encuentra en las biopsias incisionales o por punción. Para tumores en el prepucio, se recurre a la «circuncisión radical».
Para las lesiones glandulares y coronales, existen opciones quirúrgicas como la amplia escisión local, la parcial o total glandectomía con posterior reconstrucción. Además de la cirugía, la radioterapia se plantea como una alternativa válida para el tratamiento de estas lesiones.
- Escisión local amplia y circuncisión
Además de tratar el cáncer de pene prepucial, la circuncisión combinada con tratamiento tópico, terapia con láser o braquiterapia facilita las revisiones de estos pacientes(53). Para el cáncer de pene prepucial pequeño y distal, la circuncisión por sí sola suele ser un tratamiento adecuado. Las lesiones ubicadas en la corona o el glande, de tamaño limitado, pueden ser tratadas con una escisión local amplia que debe incluir un margen de piel de apariencia normal clínicamente alrededor del tumor y del eritema circundante. Estudios sugieren que la mayoría de las lesiones no se extienden más de 5-10 mm más allá del margen macroscópico, lo que resulta en tasas de recurrencia aceptablemente bajas(54). Sin embargo, no hay evidencia comparativa sólida sobre qué ancho de margen macroscópico negativo es oncológicamente seguro. En tumores de menor riesgo, márgenes mínimos de alrededor de 1 mm pueden ser adecuados, pero en lesiones más grandes o de mayor grado, es prudente considerar un margen más amplio (55). Hay pocos datos disponibles sobre la escisión local amplia; hasta ahora, la técnica solo se ha descrito en series retrospectivas que combinan varios tipos de tratamientos de preservación del órgano.
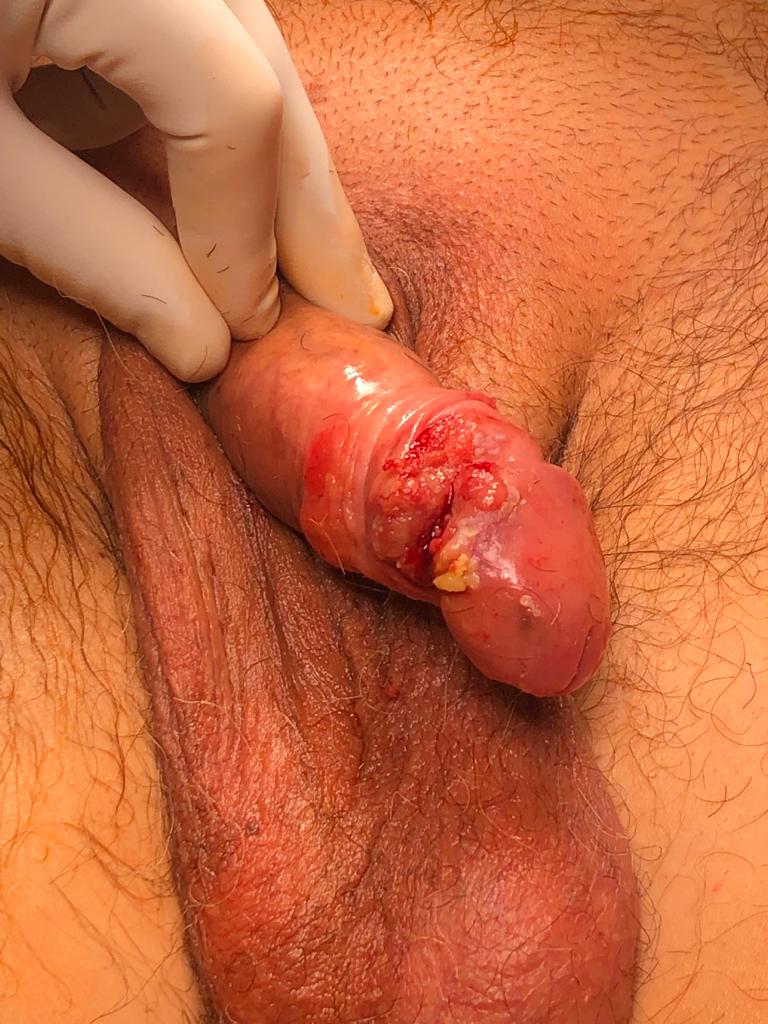
FOTOS:
ESCISIÓN LOCAL AMPLIA CON MÁRGENES DE TUMOR EN GLANDE Y PREPUCIO
CORTESÍA DR. AGUSTÍN FRAILE. H.U. RAMÓN Y CAJAL
- Cirugia micrográfica de Moh’s
Es una técnica quirúrgica en la cual el tejido es extirpado y procesado con márgenes histológicos en tiempo real para obtener un margen completo circunferencial y profundo. Su objetivo principal es preservar al máximo el órgano mediante una extirpación guiada por márgenes. Tres estudios informaron sobre la tasa de supervivencia libre de recurrencia a 5 años en 51 hombres, la mayoría con enfermedad T1. Las tasas de supervivencia libre de recurrencia variaron con un promedio acumulado a 5 años. Dado que los datos son muy limitados, no se recomienda de manera rutinaria (48).
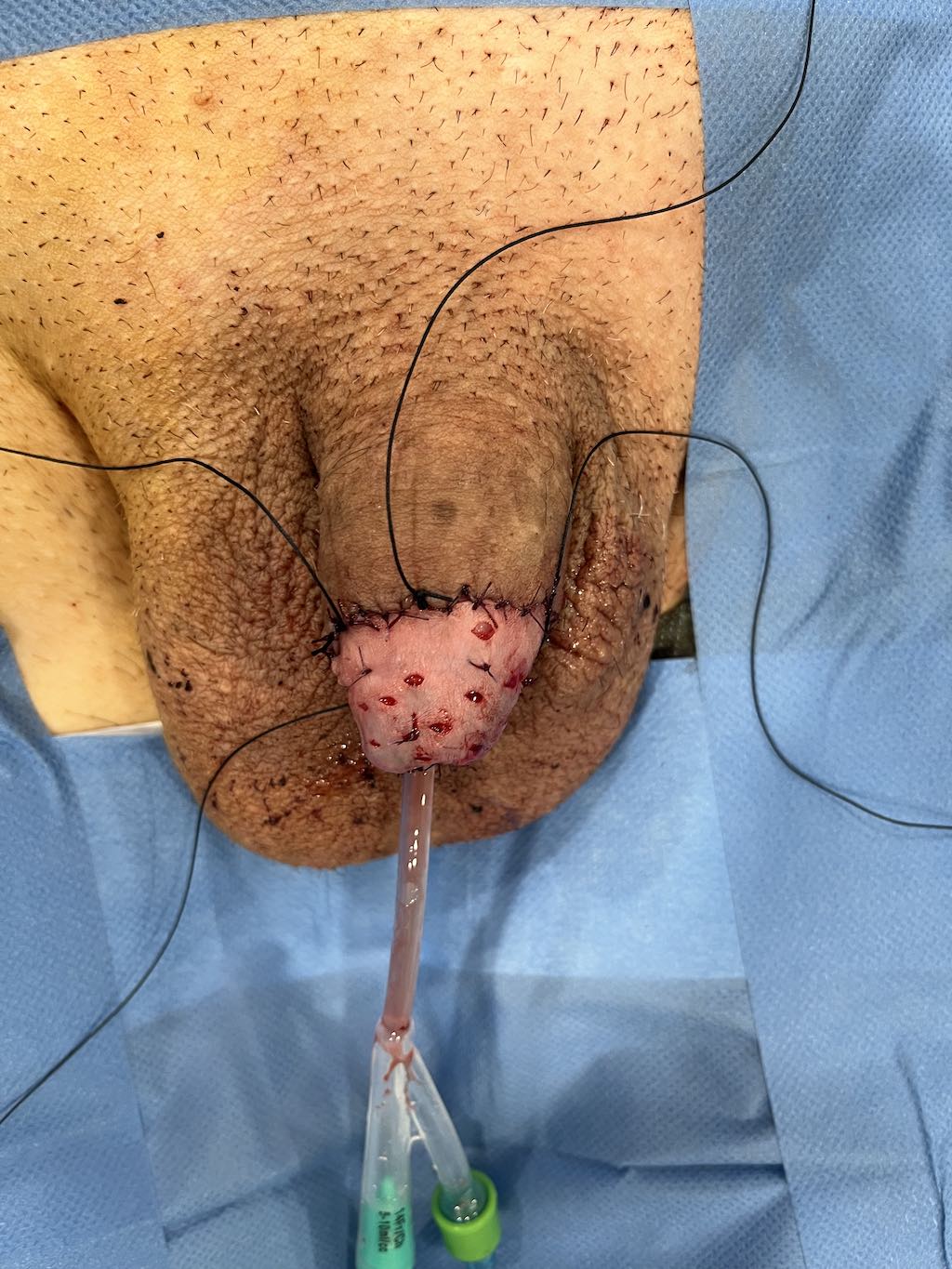
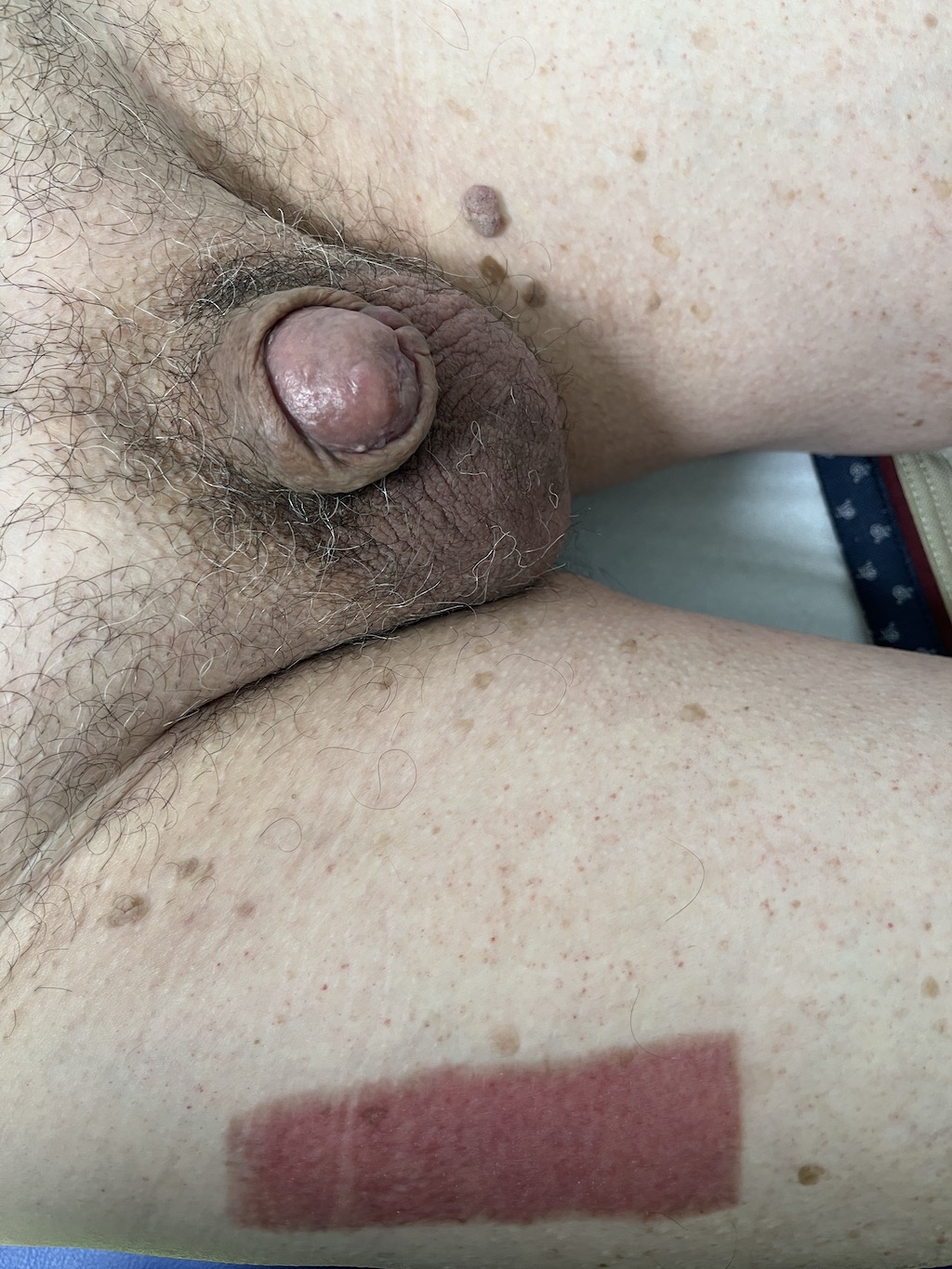
- Resurfacing
Además de sus efectos establecidos en la terapia de PeIN, el resurfacing total o parcial del glande se ha informado como una opción para lesiones superficialmente invasivas combinadas con una resección más profunda en el sitio de invasión. La literatura es heterogénea, con muchos estudios que informan sobre diversas técnicas de cirugía de preservación de órganos, incluido el resurfacing del glande, sin especificar la invasión tumoral en estos pacientes en particular. Cinco estudios han informado resultados de resurfacing del glande específicamente en cáncer de pene invasivo en un total de 68 pacientes, la mayoría con pT1 y algunos casos de lesiones T2, con tasas de supervivencia libre de recurrencia que oscilan entre el 75% y el 96.6% (55–59). Al igual que el resurfacing del glande aplicado al carcinoma in situ, las complicaciones relacionadas con el injerto son raras y, según la evaluación de los pacientes, la cosmética generalmente es buena.
- Glandectomía
La glandectomía tiene como objetivo proporcionar resultados funcionales y estéticos superiores en comparación con la penectomía parcial. Durante la cirugía, se debe prestar especial atención al examen de los márgenes intraoperatorios para asegurar la completa extirpación del tumor, dejando un lecho y borde libres de tumor. A pesar de los esfuerzos, la recurrencia local puede ocurrir en un rango del 12% al 5% de los casos y, en tales situaciones, la penectomía parcial se considera una opción de tratamiento viable (48). Estas técnicas se recomiendan especialmente para tumores T2 que se limitan al glande. Es importante mencionar que algunos trabajos también han señalado recurrencias inguinales en un rango del 9% al 12% y metástasis a distancia en aproximadamente un 2% (54).
La resección parcial del glande es una opción válida cuando la lesión no afecta los cuerpos cavernosos o compromete menos de la mitad del glande. En estos casos, la reconstrucción se lleva a cabo mediante injertos de piel parcial o el avance de la piel peneana o de la mucosa uretral, que se moviliza y espatula en su cara ventral para cubrir el defecto. Desde una perspectiva funcional, estas cirugías pueden preservar la capacidad eréctil y la capacidad de penetración, ya que se logra una longitud mayor en comparación con una penectomía parcial convencional.
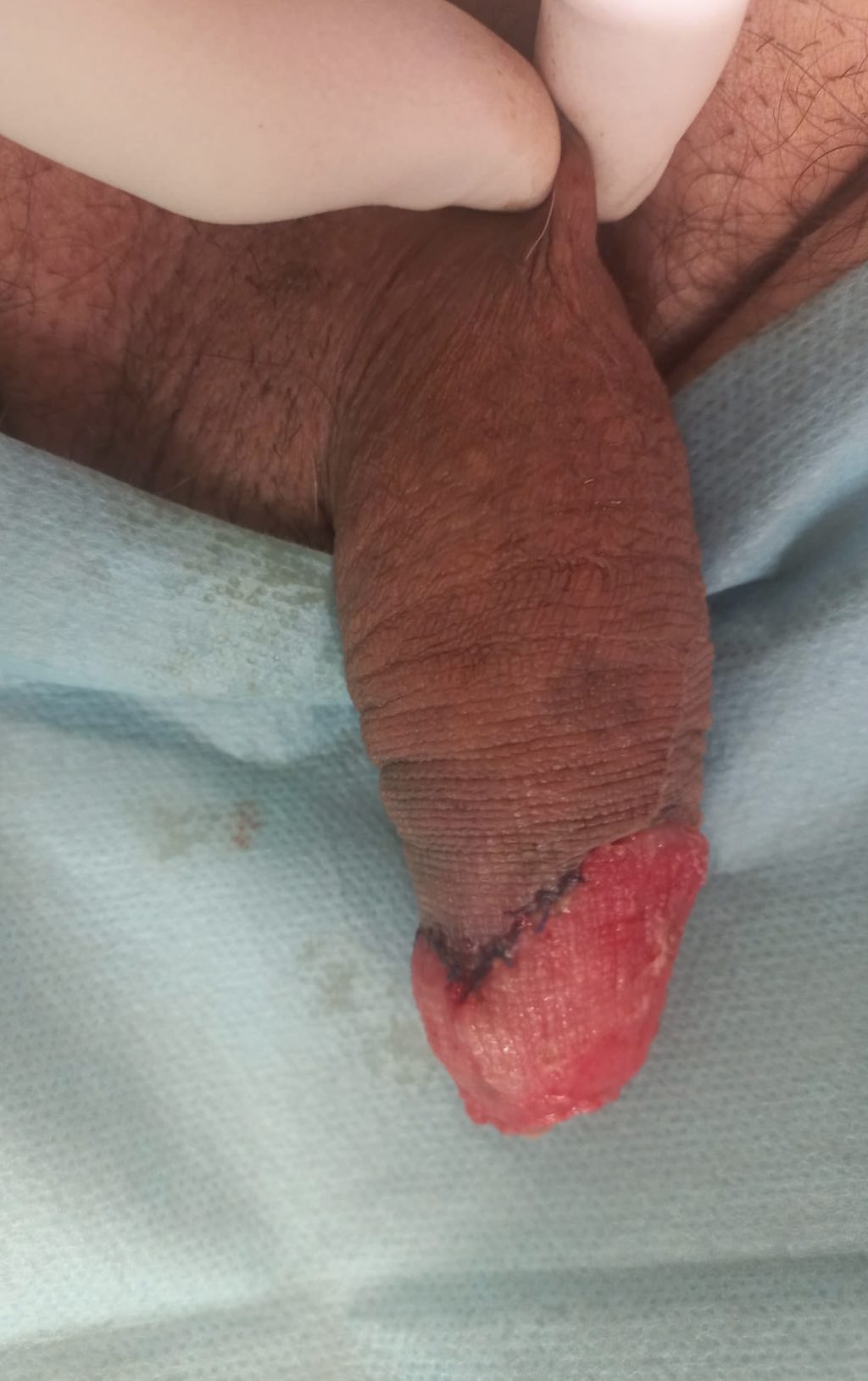
FOTOS:
GLANDECTOMÍA Y COBERTURA CUERPOS CAVERNOSOS CON INJERTO, CONSIGUIENDO APARIENCIA ESTÉTICA DE GLANDE.
CORTESÍA DR. AGUSTÍN FRAILE. H.U. RAMÓN Y CAJAL
- Penectomía parcial
Para algunas lesiones invasoras en la parte distal del cuerpo del pene y el glande, con afectación de los cavernosos, se recomienda la penectomía parcial con un margen de seguridad adecuado. Esta técnica debe permitir la micción de pie sin necesidad de retraer el escroto. La penectomía parcial ofrece un excelente control de la enfermedad, con una tasa de recurrencia local del 6%, metástasis ganglionar en el 8% de los casos y un 7.2% de márgenes quirúrgicos positivos, según uno de los informes más extensos con un total de 2360 pacientes sometidos a penectomía parcial (60).
La técnica quirúrgica comprende el aislamiento de la lesión, que generalmente está infectada, y la demarcación de un margen de piel sana. Luego, utilizando un control vascular proximal tipo torniquete, se procede a la sección de la piel, el dartos, la fascia de Buck y los cuerpos cavernosos. Los cuerpos cavernosos se suturan con material sintético reabsorbible, y se completa la hemostasia sin inducir isquemia en el pene. El muñón peneano se cubre mediante un avance de la piel remanente o mediante un injerto de piel parcial que se coloca sobre los cuerpos cavernosos amputados, creando así un neoglande. La uretra se espátula en la cara ventral para formar un neomeato.
Si el pene remanente tiene una longitud inferior a 2-3 cm, se pueden considerar técnicas de reconstrucción que incluyen la sección del ligamento suspensorio, la sutura de la piel en la base del pene y la cobertura del cuerpo peneano desnudo mediante injertos de piel o colgajos pediculados del escroto.
No hay evidencia comparativa sólida entre la penectomía parcial y la glandectomía. Sin embargo, la mayoría de las series de casos sugieren tasas de recurrencia local similares entre ambas cirugías. En alguna serie centrada exclusivamente en lesiones T1 y T2, se observó que la cirugía amputativa tenía tasas de recurrencia local a los 5 años superiores a la cirugía de preservación del pene. Esto sugiere que una resección más amplia puede ofrecer cierta protección contra la recurrencia local, pero es importante considerar el impacto en la función sexual y la calidad de vida al tomar una decisión sobre el tipo de cirugía a realizar (48).
En el caso de la enfermedad cT2, cuando existe duda sobre la invasión del cuerpo o la túnica albugínea, en lugar de continuar la disección sobre la fascia de Buck para realizar una glandectomía combinada con corporectomía distal, se puede adoptar la disección superficial a la túnica albugínea después de dividir el paquete neurovascular. La resonancia magnética o la ecografía preoperatorias pueden ayudar en la planificación quirúrgica,
- Consideraciones Sobre la Cirugía Conservadora
Es importante destacar que aunque se ha observado una tendencia hacia la cirugía conservadora, la elección del tratamiento sigue dependiendo de varios factores, como el tamaño del tumor, su histología, estadio, grado, ubicación y las preferencias del paciente. Se necesita una evaluación cuidadosa para determinar la estrategia óptima.
Un aspecto crítico que considerar es la recidiva local, que puede tener implicaciones significativas en la supervivencia del paciente. En estudios de tumores de alto riesgo tratados con glandectomía o penectomía parcial, se observó que los pacientes que experimentaron recurrencia local tenían una peor supervivencia, incluso después de ajustar por factores pronósticos desfavorables (61,62). Sin embargo, esto no sugiere necesariamente que una resección más radical habría mejorado el pronóstico, ya que la recurrencia local en estos casos podría reflejar una biología tumoral más agresiva en general.
En última instancia, el tratamiento de las lesiones invasoras de pene implica un equilibrio delicado entre la preservación del órgano y la gestión efectiva del cáncer. Los riesgos más altos de recurrencia local asociados con la cirugía conservadora deben discutirse con el paciente al elaborar un plan de tratamiento. Cada enfoque terapéutico tiene sus ventajas y desventajas, y la elección debe basarse en una evaluación minuciosa y en la toma de decisiones compartida entre el médico y el paciente.
Enfermedad localmente avanzada (T3-T4)
Enfermedad resecable. Penectomía parcial vs total
Para los pacientes cT3 con evidente compromiso de los cuerpos cavernosos, la amputación parcial es estándar. A los pacientes se les pueden ofrecer opciones reconstructivas como la centralización uretral y/o la formación de un neoglande con el uso de un injerto. Algunos estudios en pacientes de mayor riesgo tratados con glandectomía radical o penectomía parcial muestran que la recurrencia local en estos casos se asocia con una baja supervivencia (62,63). Los pacientes deben ser informados de que una resección más amplia proporciona un menor riesgo de recurrencia local.
La amputación radical y la derivación urinaria con una uretrostomía perineal se reservan para aquellos pacientes en los que una resección con un margen seguro resultaría en la incapacidad de orinar de pie o sin mojar el escroto. También se puede considerar en situaciones donde se presentan lesiones grandes en la parte distal con metástasis loco-regionales, con el propósito de realizar una limpieza y un tratamiento local paliativo.En la mayoría de los casos de lesiones primarias T3-T4, se requerirá una planificación de tratamiento compleja.
En la penectomía total, se lleva a cabo una incisión circular en la base del pene con extensión hasta el rafe medio del escroto. Los cuerpos cavernosos se seccionan a nivel de la crura, y la uretra bulbar se libera para alcanzar el periné, o se puede realizar una uretrostomía perineal con una apertura ventral de la uretra bulbar.
En el caso de pacientes jóvenes que tienen una supervivencia libre de recurrencia local y a distancia, y que desean recuperar su imagen corporal, existe la posibilidad de realizar la reconstrucción del pene con un colgajo libre pediculado de antebrazo utilizando la arteria radial. Sin embargo, esta opción se considera excepcional debido a su alta complejidad y a las tasas de complicaciones, tanto en el sitio donante como en la uretra.
Tabla 4: Resumen de las recomendaciones quirúrgicas del tratamiento según estadio
|
ESTADIO T |
TRATAMIENTO |
|
PeIN, Ta-T1A |
Imiquimod, 5-Fluorouracilo, Laser CO2- Nd-YAG, resurfacing, Mohs. Escisión. |
|
T1B Y T2 (glande) |
Escisión, glandectomía parcial o total |
|
T2 (cavernoso) |
Penectomía parcial |
|
T3 |
Penectomía parcial/total |
|
T4 |
Quimioterapia adjuvante +penectomía total. Evaluar radioterapia |
Papel de la RT en el control local.
La radioterapia despliega su papel crucial en el abordaje del cáncer de pene en las etapas tempranas T1 y T2, en situaciones seleccionadas como otra estrategia de preservación de órganos. Su objetivo es obtener resultados terapéuticos comparables a los de la cirugía, conservando la función del órgano y minimizando la morbilidad. En las fases más tempranas, la radioterapia se administra mediante dos enfoques: la radioterapia externa y la braquiterapia, o bien una combinación de ambas. La braquiterapia se ha estudiado solo para lesiones menores de 4 cm, por lo que su uso debe limitarse a tumores que no excedan este tamaño (64).
La elección entre radioterapia externa y braquiterapia se determina según la ubicación y el tamaño del tumor, así como la disponibilidad de equipamiento y experiencia clínica. La radioterapia externa presenta la ventaja de estar más ampliamente disponible y de proporcionar una distribución de dosis más uniforme con márgenes de seguridad adicionales alrededor del tumor. Antes de iniciar cualquier tratamiento radioterapéutico, se recomienda la realización de una circuncisión para exponer adecuadamente la lesión.
Para pacientes sometidos a braquiterapia de baja dosis, las tasas de control local a 5 años oscilan entre el 70% y el 90%. El control local tiende a disminuir en casos de enfermedad en etapas más avanzadas, con un grado histológico más alto y una mayor profundidad de la lesión. La preservación del pene a los 5 años se encuentra en un rango del 70% al 88%(65). En cuanto a los estudios que evaluar la eficacia de la radioterapia externa y braquiterapia, las tasas acumulativas medias de supervivencia libre de recurrencia a 5 años fueron del 78.6% después de la braquiterapia y del 55.2% después de la radioterapia externa. Cuatro estudios (que incluyeron algunas cohortes de radioterapia externa y algunas de braquiterapia) informaron tasas de supervivencia libre de recurrencia por estadio de la enfermedad, con tasas de 5 años para T1 que van del 59% al 94%, del 50% al 67% en T2 y del 17% al 77% en T3 (47).
En los pocos estudios que compararon el tratamiento quirúrgico y la radioterapia, los resultados de la cirugía fueron ligeramente mejores. En un metaanálisis que comparaba la cirugía y la braquiterapia, las tasas de supervivencia a los 5 años y de control local fueron del 76 al 84% para la cirugía y del 73 al 79% para la braquiterapia, respectivamente. La tasa de preservación de órganos para la braquiterapia fue del 74% y no hubo diferencia en la supervivencia. La recurrencia local después de la radioterapia puede ser tratada con cirugía(66).
Los efectos secundarios más comunes incluyen la ulceración del tejido blando y la estenosis del meato (67).
8. BIBLIOGRAFÍA
1. Daubisse-Marliac L, Colonna M, Trétarre B, Defossez G, Molinié F, Jéhannin-Ligier K, et al. Long-term trends in incidence and survival of penile cancer in France. Cancer Epidemiol. 2017 Oct;50(Pt A):125–31.
2. Velazquez EF, Chaux A, Cubilla AL. Histologic classification of penile intraepithelial neoplasia. Semin Diagn Pathol. 2012 May;29(2):96–102.
3. Capítulo 30 – Cáncer de pene – Manual de Urología. Available from: https://manualdeurologia.cl/capitulo-30-cancer-de-pene/
4. Montes Cardona CE, García-Perdomo HA. Incidence of penile cancer worldwide: systematic review and meta-analysis. Rev Panam Salud Pública. 2017 Nov 30;41:e117.
5. Cancer Research UK [Internet]. 2015 [cited 2023 Sep 29]. Penile cancer incidence statistics. Available from: https://www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/penile-cancer/incidence
6. Chaux A, Netto GJ, Rodríguez IM, Barreto JE, Oertell J, Ocampos S, et al. Epidemiologic profile, sexual history, pathologic features, and human papillomavirus status of 103 patients with penile carcinoma. World J Urol. 2013 Aug;31(4):861–7.
7. Douglawi A, Masterson TA. Updates on the epidemiology and risk factors for penile cancer. Transl Androl Urol. 2017 Oct;6(5):785–90.
8. Rubin MA, Kleter B, Zhou M, Ayala G, Cubilla AL, Quint WG, et al. Detection and typing of human papillomavirus DNA in penile carcinoma: evidence for multiple independent pathways of penile carcinogenesis. Am J Pathol. 2001 Oct;159(4):1211–8.
9. von Krogh G, Horenblas S. Diagnosis and clinical presentation of premalignant lesions of the penis. Scand J Urol Nephrol Suppl. 2000;(205):201–14.
10. Barbagli G, Palminteri E, Mirri F, Guazzoni G, Turini D, Lazzeri M. Penile carcinoma in patients with genital lichen sclerosus: a multicenter survey. J Urol. 2006 Apr;175(4):1359–63.
11. H M, PA H, TM U, VE R. WHO Classification of Tumours of the Urinary System and Male Genital Organs [Internet]. [cited 2023 Oct 8]. Available from: https://publications.iarc.fr/Book-And-Report-Series/Who-Classification-Of-Tumours/WHO-Classification-Of-Tumours-Of-The-Urinary-System-And-Male-Genital-Organs-2016
12. Sanchez DF, Soares F, Alvarado-Cabrero I, Cañete S, Fernández-Nestosa MJ, Rodríguez IM, et al. Pathological factors, behavior, and histological prognostic risk groups in subtypes of penile squamous cell carcinomas (SCC). Semin Diagn Pathol. 2015 May;32(3):222–31.
13. Thomas A, Necchi A, Muneer A, Tobias-Machado M, Tran ATH, Van Rompuy AS, et al. Penile cancer. Nat Rev Dis Primer. 2021 Feb 11;7(1):11.
14. Brouwer OR, Albersen M, Parnham A, Protzel C, Pettaway CA, Ayres B, et al. European Association of Urology-American Society of Clinical Oncology Collaborative Guideline on Penile Cancer: 2023 Update. Eur Urol. 2023 Jun;83(6):548–60.
15. Aumayr K, Susani M, Horvat R, Wrba F, Mazal P, Klatte T, et al. P16INK4A immunohistochemistry for detection of human papilloma virus-associated penile squamous cell carcinoma is superior to in-situ hybridization. Int J Immunopathol Pharmacol. 2013;26(3):611–20.
16. Winters BR, Mossanen M, Holt SK, Lin DW, Wright JL. Predictors of Nodal Upstaging in Clinical Node Negative Patients With Penile Carcinoma: A National Cancer Database Analysis. Urology. 2016 Oct;96:29–34.
17. Cubilla AL. The role of pathologic prognostic factors in squamous cell carcinoma of the penis. World J Urol. 2009 Apr;27(2):169–77.
18. Li Z, Li X, Lam W, Cao Y, Geng J, Ornellas AA, et al. Corpora Cavernos invasion vs. Corpus Spongiosum invasion in Penile Cancer: A systematic review and meta-analysis. J Cancer. 2021;12(7):1960–6.
19. Olesen TB, Sand FL, Rasmussen CL, Albieri V, Toft BG, Norrild B, et al. Prevalence of human papillomavirus DNA and p16INK4a in penile cancer and penile intraepithelial neoplasia: a systematic review and meta-analysis. Lancet Oncol. 2019 Jan;20(1):145–58.
20. Brierley, J., et al. TNM Classification of Malignant Tumours. 8th ed. 2016.
21. Amin MB, Greene FL, Edge SB, Compton CC, Gershenwald JE, Brookland RK, et al. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging. CA Cancer J Clin. 2017 Mar;67(2):93–9.
22. Burgers JK, Badalament RA, Drago JR. Penile cancer. Clinical presentation, diagnosis, and staging. Urol Clin North Am. 1992 May;19(2):247–56.
23. Chipollini J, De la Rosa AH, Azizi M, Shayegan B, Zorn KC, Spiess PE. Patient presentation, differential diagnosis, and management of penile lesions. Can Urol Assoc J J Assoc Urol Can. 2019 Feb;13(2 Suppl 1):S2–8.
24. Lont AP, Besnard APE, Gallee MPW, van Tinteren H, Horenblas S. A comparison of physical examination and imaging in determining the extent of primary penile carcinoma. BJU Int. 2003 Apr;91(6):493–5.
25. Bertolotto M, Serafini G, Dogliotti L, Gandolfo N, Gandolfo NG, Belgrano M, et al. Primary and secondary malignancies of the penis: ultrasound features. Abdom Imaging. 2005;30(1):108–12.
26. Kayes O, Minhas S, Allen C, Hare C, Freeman A, Ralph D. The role of magnetic resonance imaging in the local staging of penile cancer. Eur Urol. 2007 May;51(5):1313–8; discussion 1318-1319.
27. Wood HM, Angermeier KW. Anatomic considerations of the penis, lymphatic drainage, and biopsy of the sentinel node. Urol Clin North Am. 2010 Aug;37(3):327–34.
28. Horenblas S, van Tinteren H. Squamous cell carcinoma of the penis. IV. Prognostic factors of survival: analysis of tumor, nodes and metastasis classification system. J Urol. 1994 May;151(5):1239–43.
29. Srinivas V, Morse MJ, Herr HW, Sogani PC, Whitmore WF. Penile cancer: relation of extent of nodal metastasis to survival. J Urol. 1987 May;137(5):880–2.
30. Woldu SL, Ci B, Hutchinson RC, Krabbe LM, Singla N, Passoni NM, et al. Usage and survival implications of surgical staging of inguinal lymph nodes in intermediate- to high-risk, clinical localized penile cancer: A propensity-score matched analysis. Urol Oncol. 2018 Apr;36(4):159.e7-159.e17.
31. Mueller-Lisse UG, Scher B, Scherr MK, Seitz M. Functional imaging in penile cancer: PET/computed tomography, MRI, and sentinel lymph node biopsy. Curr Opin Urol. 2008 Jan;18(1):105–10.
32. Leijte JAP, Graafland NM, Valdés Olmos RA, van Boven HH, Hoefnagel CA, Horenblas S. Prospective evaluation of hybrid 18F-fluorodeoxyglucose positron emission tomography/computed tomography in staging clinically node-negative patients with penile carcinoma. BJU Int. 2009 Sep;104(5):640–4.
33. Schlenker B, Scher B, Tiling R, Siegert S, Hungerhuber E, Gratzke C, et al. Detection of inguinal lymph node involvement in penile squamous cell carcinoma by 18F-fluorodeoxyglucose PET/CT: a prospective single-center study. Urol Oncol. 2012;30(1):55–9.
34. Krishna RP, Sistla SC, Smile R, Krishnan R. Sonography: an underutilized diagnostic tool in the assessment of metastatic groin nodes. J Clin Ultrasound JCU. 2008 May;36(4):212–7.
35. Kroon BK, Horenblas S, Deurloo EE, Nieweg OE, Teertstra HJ. Ultrasonography-guided fine-needle aspiration cytology before sentinel node biopsy in patients with penile carcinoma. BJU Int. 2005 Mar;95(4):517–21.
36. Lee EWC, Issa A, Oliveira P, Lau M, Sangar V, Parnham A, et al. High diagnostic accuracy of inguinal ultrasonography and fine-needle aspiration followed by dynamic sentinel lymph node biopsy in men with impalpable and palpable inguinal lymph nodes. BJU Int. 2022 Sep;130(3):331–6.
37. Fankhauser CD, de Vries HM, Roussel E, Jakobsen JK, Issa A, Lee EWC, et al. Lymphovascular and perineural invasion are risk factors for inguinal lymph node metastases in men with T1G2 penile cancer. J Cancer Res Clin Oncol. 2022 Sep;148(9):2231–4.
38. Graafland NM, Lam W, Leijte JAP, Yap T, Gallee MPW, Corbishley C, et al. Prognostic factors for occult inguinal lymph node involvement in penile carcinoma and assessment of the high-risk EAU subgroup: a two-institution analysis of 342 clinically node-negative patients. Eur Urol. 2010 Nov;58(5):742–7.
39. Muñoz Guillermo V, Rosino Sánchez A, Rivero Guerra Á, Barceló Bayonas I, Pardo Martínez A, Jiménez Peralta D, et al. [Video endoscopic inguinal lymphadenectomy in penile cancer: Systematic review.]. Arch Esp Urol. 2019 Dec;72(10):992–9.
40. Horenblas S, Jansen L, Meinhardt W, Hoefnagel CA, de Jong D, Nieweg OE. Detection of occult metastasis in squamous cell carcinoma of the penis using a dynamic sentinel node procedure. J Urol. 2000 Jan;163(1):100–4.
41. de Vries HM, Lee HJ, Lam W, Djajadiningrat RS, Ottenhof SR, Roussel E, et al. Clinicopathological predictors of finding additional inguinal lymph node metastases in penile cancer patients after positive dynamic sentinel node biopsy: a European multicentre evaluation. BJU Int. 2022 Jul;130(1):126–32.
42. Wever L, de Vries HM, Dell’Oglio P, van der Poel HG, Donswijk ML, Sikorska K, et al. Incidence and risk factor analysis of complications after sentinel node biopsy for penile cancer. BJU Int. 2022 Oct;130(4):486–95.
43. Leijte JAP, Kroon BK, Valdés Olmos RA, Nieweg OE, Horenblas S. Reliability and safety of current dynamic sentinel node biopsy for penile carcinoma. Eur Urol. 2007 Jul;52(1):170–7.
44. Hughes B, Leijte J, Shabbir M, Watkin N, Horenblas S. Non-invasive and minimally invasive staging of regional lymph nodes in penile cancer. World J Urol. 2009 Apr;27(2):197–203.
45. Hövels AM, Heesakkers R a. M, Adang EM, Jager GJ, Strum S, Hoogeveen YL, et al. The diagnostic accuracy of CT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis. Clin Radiol. 2008 Apr;63(4):387–95.
46. Graafland NM, Leijte JAP, Valdés Olmos RA, Hoefnagel CA, Teertstra HJ, Horenblas S. Scanning with 18F-FDG-PET/CT for detection of pelvic nodal involvement in inguinal node-positive penile carcinoma. Eur Urol. 2009 Aug;56(2):339–45.
47. Uroweb – European Association of Urology EAU Guidelines on Penile Cancer – – Uroweb. Available from: https://uroweb.org/guidelines/penile-cancer/chapter/disease-management
48. Sakalis VI, Campi R, Barreto L, Perdomo HG, Greco I, Zapala Ł, et al. What Is the Most Effective Management of the Primary Tumor in Men with Invasive Penile Cancer: A Systematic Review of the Available Treatment Options and Their Outcomes. Eur Urol Open Sci. 2022 Jun;40:58–94.
49. Kravvas G, Ge L, Ng J, Shim TN, Doiron PR, Watchorn R, et al. The management of penile intraepithelial neoplasia (PeIN): clinical and histological features and treatment of 345 patients and a review of the literature. J Dermatol Treat. 2022 Mar;33(2):1047–62.
50. Kristiansen S, Torbrand C, Svensson Å, Forslund O, Bjartling C. Incidence of penile intraepithelial neoplasia and treatment strategies in Sweden 2000-2019. BJU Int. 2022 Jun;129(6):752–9.
51. Issa A, Sebro K, Kwok A, Janisch F, Grossmann NC, Lee E, et al. Treatment Options and Outcomes for Men with Penile Intraepithelial Neoplasia: A Systematic Review. Eur Urol Focus. 2022 May;8(3):829–32.
52. Shabbir M, Muneer A, Kalsi J, Shukla CJ, Zacharakis E, Garaffa G, et al. Glans resurfacing for the treatment of carcinoma in situ of the penis: surgical technique and outcomes. Eur Urol. 2011 Jan;59(1):142–7.
53. Kamel MH, Bissada N, Warford R, Farias J, Davis R. Organ Sparing Surgery for Penile Cancer: A Systematic Review. J Urol. 2017 Oct;198(4):770–9.
54. Philippou P, Shabbir M, Malone P, Nigam R, Muneer A, Ralph DJ, et al. Conservative surgery for squamous cell carcinoma of the penis: resection margins and long-term oncological control. J Urol. 2012 Sep;188(3):803–8.
55. Sri D, Sujenthiran A, Lam W, Minter J, Tinwell BE, Corbishley CM, et al. A study into the association between local recurrence rates and surgical resection margins in organ-sparing surgery for penile squamous cell cancer. BJU Int. 2018 Oct;122(4):576–82.
56. Cakir OO, Schifano N, Venturino L, Pozzi E, Castiglione F, Alnajjar HM, et al. Surgical technique and outcomes following coronal-sparing glans resurfacing for benign and malignant penile lesions. Int J Impot Res. 2022 Aug;34(5):495–500.
57. Falcone M, Preto M, Oderda M, Timpano M, Russo GI, Capogrosso P, et al. Total Glans Resurfacing for the Management of Superficial Penile Cancer: A Retrospective Cohort Analysis in a Tertiary Referral Center. Urology. 2020 Nov;145:281–6.
58. Pérez J, Chavarriaga J, Ortiz A, Orrego P, Rueda S, Quiroga W, et al. Oncological and Functional Outcomes After Organ-Sparing Plastic Reconstructive Surgery for Penile Cancer. Urology. 2020 Aug;142:161-165.e1.
59. O’Kelly F, Lonergan P, Lundon D, Nason G, Sweeney P, Cullen I, et al. A Prospective Study of Total Glans Resurfacing for Localized Penile Cancer to Maximize Oncologic and Functional Outcomes in a Tertiary Referral Network. J Urol. 2017 May;197(5):1258–63.
60. Kamel MH, Tao J, Su J, Khalil MI, Bissada NK, Schurhamer B, et al. Survival outcomes of organ sparing surgery, partial penectomy, and total penectomy in pathological T1/T2 penile cancer: Report from the National Cancer Data Base. Urol Oncol. 2018 Feb;36(2):82.e7-82.e15.
61. Djajadiningrat RS, van Werkhoven E, Meinhardt W, van Rhijn BWG, Bex A, van der Poel HG, et al. Penile sparing surgery for penile cancer-does it affect survival? J Urol. 2014 Jul;192(1):120–5.
62. Roussel E, Peeters E, Vanthoor J, Bozzini G, Muneer A, Ayres B, et al. Predictors of local recurrence and its impact on survival after glansectomy for penile cancer: time to challenge the dogma? BJU Int. 2021 May;127(5):606–13.
63. Djajadiningrat RS, Bergman AM, van Werkhoven E, Vegt E, Horenblas S. Neoadjuvant taxane-based combination chemotherapy in patients with advanced penile cancer. Clin Genitourin Cancer. 2015 Feb;13(1):44–9.
64. Crook J, Jezioranski J, Cygler JE. Penile brachytherapy: technical aspects and postimplant issues. Brachytherapy. 2010;9(2):151–8.
65. Delaunay B, Soh PN, Delannes M, Riou O, Malavaud B, Moreno F, et al. Brachytherapy for penile cancer: efficacy and impact on sexual function. Brachytherapy. 2014;13(4):380–7.
66. Hasan S, Francis A, Hagenauer A, Hirsh A, Kaminsky D, Traughber B, et al. The role of brachytherapy in organ preservation for penile cancer: A meta-analysis and review of the literature. Brachytherapy. 2015;14(4):517–24.
67. de Crevoisier R, Slimane K, Sanfilippo N, Bossi A, Albano M, Dumas I, et al. Long-term results of brachytherapy for carcinoma of the penis confined to the glans (N- or NX). Int J Radiat Oncol Biol Phys. 2009 Jul 15;74(4):1150–6.