Artiles Medina, A.1 Mínguez Ojeda, C. 1 Juez Saez, L. D. 2 Arribas Terradillos, S. 1 Domínguez Gutiérrez, A. 1 Sánchez González, A. 1 Subiela Henríquez, J. D. 1 Brasero Burgos, J. 1 González Tello, F. 3 Cruz Redondo, A. B. 4 Gómez Dos Santos, V. 1 Jiménez Cidre, M. Á. 1 Burgos Revilla, F. J. 1
- Servicio de Urología. Hospital Universitario Ramón y Cajal, Madrid. Universidad de Alcalá de Henares.
- Servicio de Cirugía general y digestiva. Hospital Universitario Ramón y Cajal, Madrid.
- Servicio de Radiodiagnóstico. Hospital Universitario Ramón y Cajal, Madrid.
- Enfermera especializada en Recuperación Intensiva en Cirugía del Adulto (RICA). Unidad de Continuidad Asistencial. Hospital Universitario Ramón y Cajal, Madrid.
1. Introducción
La cistectomía radical (CR) con linfadenectomía pélvica y derivación urinaria es el tratamiento estándar para el cáncer vesical músculo-invasivo no metastásico, y para algunos casos de cáncer vesical no músculo-invasivo de alto riesgo, en pacientes aptos para cirugía mayor.
La CR se asocia con una alta morbimortalidad postoperatoria, habiéndose realizado diversos intentos de reducir dicha tasa de complicaciones, como la introducción de los programas Enhanced Recovery After Surgery (ERAS).
El análisis de la morbimortalidad perioperatoria sigue siendo de gran importancia para el asesoramiento preoperatorio de los pacientes candidatos a CR, la planificación del tratamiento, la identificación de factores de riesgo modificables para reducir dicha morbimortalidad, el diseño de ensayos clínicos futuros y la evaluación de la calidad quirúrgica1.
En esta revisión abordamos la incidencia de las complicaciones postoperatorias (quirúrgicas) a corto plazo (<90 días) tras CR, así como su diagnóstico y manejo.
La tasa global de complicaciones tras CR está en torno al 58,5% (rango 36,1-80,5) para complicaciones a los 90 días. Los tipos de complicaciones más comunes son las gastrointestinales (29,0%) e infecciosas (26,4%). La tasa de mortalidad se sitúa en el 2,4 % (rango 0,9–4,7) para la mortalidad durante el ingreso y en el 4,7 % (rango 0,0–7,0) para la mortalidad a 90 días, considerándose la edad y comorbilidades como predictores de complicaciones postquirúrgicas1.
Tabla 1. Incidencia de las complicaciones tempranas (a 90 días) tras cistectomía radical (Adaptado de Maibom SL y cols. 1).
2. Prevención de las complicaciones postoperatorias
El protocolo ERAS incluye una combinación de estrategias preoperatorias, intraoperatorias y postoperatorias basadas en la evidencia científica para mejorar la recuperación y funcionalidad tras un evento quirúrgico mayor, y así reducir las complicaciones quirúrgicas y minimizar los reingresos tras el alta 2. No obstante, en esta revisión no haremos mención a dichas estrategias, ya que son objeto de revisión en otro artículo de este número de la revista. En la Tabla 2 se resumen las principales medidas de prevención de las complicaciones tras CR.
Previamente a analizar cada una de las complicaciones precoces más frecuentes tras CR, se mencionarán algunos aspectos sobre el abordaje y la técnica quirúrgica, que clásicamente se ha considerado que pueden tener impacto en la incidencia de complicaciones en el postoperatorio.
En los últimos años, ha habido un creciente interés y un aumento en la aplicación de técnicas mínimamente invasivas (abordajes laparoscópico o robótico) en la CR. Según algunos metaanálisis, el abordaje quirúrgico no tiene un impacto considerable en los resultados oncológicos, de seguridad y de calidad de vida en pacientes sometidos a CR. Los beneficios que confiere la cistectomía radical laparoscópica y asistida por robot (RARC) son una menor necesidad de transfusiones sanguíneas y una menor estancia hospitalaria 3 , 4. La RARC puede ser más adecuada para CR con derivación urinaria intracorpórea 5.
Con respecto a la técnica quirúrgica para realizar la anastomosis intestinal, no se ha analizado específicamente en la literatura la superioridad de una anastomosis intestinal mecánica con grapas frente a la anastomosis manual en el ámbito de la cirugía urológica. Solo en cirugía gastrointestinal los estudios favorecieron tiempos quirúrgicos más cortos usando anastomosis con grapas en lugar de suturadas a mano, pero no se han observado diferencias en la duración de la estancia, ni se pudo encontrar una diferencia significativa entre los cierres de ileostomía/ conducto ileal con grapas y con sutura manual en la literatura urológica 6.
Con respecto a la preparación intestinal preoperatoria, esta se recomienda en caso de que se vaya a utilizar el intestino grueso para la reconstrucción a fin de reducir la contaminación. En cirugía general, una tendencia reciente ha sido la ausencia de preparación; pero en tales casos, no hay anastomosis del tracto urinario a la mucosa intestinal. Si solo se utiliza el intestino delgado, hay poca evidencia que apoye la preparación del intestino 6.
En lo relativo a la técnica de la reconstrucción urinaria, la incidencia de estenosis y fístula de la anastomosis ureterointestinal está relacionada también con factores técnicos, y podría prevenirse mediante una técnica quirúrgica meticulosa que incluyera una movilización limitada de los uréteres y la creación de una anastomosis bien vascularizada y sin tensión 7. Los dos métodos comúnmente utilizados para la anastomosis ureteroileal durante la cistectomía radical para el cáncer de vejiga son las técnicas de Bricker y Wallace. Los datos publicados sobre la incidencia de estenosis en los sitios de anastomosis son limitados. En la literatura, no se observan diferencias significativas en la formación de estenosis entre las técnicas de Bricker y Wallace. Un alto índice de masa corporal (IMC) y las fugas anastomóticas son factores que contribuyen a esta complicación 8, 9. En general, se mantienen los catéteres ureterales entre 5-10 días tras la cirugía, si bien existe controversia sobre si su uso previene realmente la fístula, e incluso algunos estudios sugieren que puede aumentar la incidencia de estenosis ureterointestinal 7. En relación con la necesidad de técnicas antirreflujo en las anastomosis ureterointestinales en las neovejigas ortotópicas, un reciente metaanálisis ha indicado que el reflujo vesicoureteral es mayor en caso de anastomosis ureteral directa con respecto a la anastomosis antirreflujo, si bien la primera no se asocia con deterioro de la función renal. Este metaanálisis concluye que el mecanismo antirreflujo en las neovejigas ortotópicas se asocia con una mayor incidencia de estenosis ureteroileal significativa en comparación con el reimplante directo, lo que puede provocar daño renal y un mayor riesgo de procedimientos quirúrgicos secundarios 10.
Por otro lado, dado que la tasa de extravasación es relativamente baja y la necesidad de una reintervención quirúrgica poco frecuente, junto con el hecho de que una fuga anastomótica generalmente se puede diagnosticar clínicamente, no se recomienda el uso rutinario de pielografía retrógrada en el postoperatorio de la CR para comprobar la anastomosis ureterointesitnal 11.
Tabla 2. Prevención de las complicaciones precoces tras CR.
3. Complicaciones quirúrgicas tempranas (<90 días tras la cirugía)
3.1 Íleo paralítico o adinámico
Íleo postoperatorio (IP) «normal» se define como el periodo de tiempo, de menos de cuatro días, desde la cirugía hasta la evacuación de flatos y/o heces con reinicio de la tolerancia de una dieta oral. En el caso contrario estaríamos ante un IP prolongado. Este cuadro clínico consiste en: distensión abdominal, dolor abdominal difuso y persistente, náuseas y/o vómitos, ausencia de tránsito intestinal o incapacidad para tolerar una dieta oral 12.
La incidencia de IP varía en la literatura según la definición utilizada. En concreto, tras una CR, la presentación obedece a múltiples factores y la incidencia oscila entre 4% hasta un 30% 13–16. No obstante, desde advenimiento de los abordajes mínimamente invasivos y los protocolos de rehabilitación multimodal 17, la incidencia global se cifra en torno al 10% 18. El diagnóstico es esencialmente clínico, pero las pruebas de laboratorio, y principalmente, los estudios radiológicos (en concreto, la Tomografía Computarizada (TC) con contraste intravenoso) son fundamentales para excluir causas de IP secundario (como obstrucción intestinal mecánica o la perforación intestinal) 19,20.
La estrategia global más eficaz consiste en minimizar los factores de riesgo que pueden precipitar y exacerbar el IP. En general son estrategias de control del dolor (restringir lo máximo posible el uso de opioides), cirugía mínimamente invasiva siempre y cuando sea posible, y la limitación del volumen de líquido en el período perioperatorio mediante una estrategia dirigida a objetivos. No se recomienda uso de sonda nasogástrica de rutina 13,17,21,22.
Una vez establecido el cuadro y descartadas las causas secundarias de IP, deben realizarse las siguientes medidas, que esencialmente son medidas de soporte 23,24.
- Manejo del dolor: evitar opiáceos y complementar la analgesia con antiinflamatorios no esteroideos o paracetamol.
- Fluidoterapia: debe administrarse sueroterapia para mantener la normovolemia. Asegurarse de un buen control de débitos de salida (vómitos, diuresis y sonda nasogástrica) y un ajuste estricto electrolítico.
- Reposo intestinal: inicialmente se recomienda reposo intestinal, aunque es posible que el paciente beba sorbos de líquidos claros, si lo tolera. Una vez que se resuelva la distensión abdominal y regresen los ruidos intestinales, se puede comenzar con una dieta líquida de forma precoz.
- Descompresión intestinal: en pacientes con vómitos importantes o continuos, o distensión abdominal significativa, se recomienda la colocación de una sonda nasogástrica.
- Soporte nutricional: los pacientes con IP que no toleran el soporte nutricional enteral a partir del 5º día postoperatorio requerirán nutrición parenteral total hasta que puedan pasar a la alimentación oral.
Todas estas medidas deben ir acompañadas de un seguimiento clínico estrecho del paciente. Además, las pruebas complementarias como las analíticas sanguíneas o los estudios radiológicos deben repetirse en 48-72 horas ante la ausencia de mejoría o empeoramiento del paciente.
Finalmente, respecto al Gastrografin® (contraste oral hiperosmolar hidrosoluble que se utiliza habitualmente para la obtención de imágenes por TC) y el uso de fármacos procinéticos o mascar chicle en el postoperatorio precoz, en base a la evidencia disponible, no puede recomendarse en el tratamiento del íleo postoperatorio prolongado 25–27.
Tabla 3. Resumen de los principales estudios de manejo de IP tras CR.
Figura 1. Algoritmo diagnóstico-terapéutico del íleo paralítico.
3.2 Infección de herida quirúrgica
La infección de herida quirúrgica es una de las complicaciones más frecuentes en la cirugía. Se estima que afecta alrededor del 2-4% de los pacientes sometidos a una cirugía. En el caso de la cistectomía, la tasa de infección de herida quirúrgica es aún más alta, alcanzando hasta el 15% de los casos33. Esta alta tasa de infección se debe a la naturaleza invasiva del procedimiento, el largo tiempo de cirugía y la manipulación de tejidos infectados. En un estudio realizado por Meyer et al.33, todos los pacientes con dehiscencia de herida quirúrgica tras cistectomía radical presentaban infección del sitio quirúrgico (ISQ), por ello es importante identificar los factores de riesgo modificables para reducir la tasa de ISQ. Algunos factores de riesgo descritos en la literatura34 son la obesidad, la diabetes, el consumo del alcohol, pacientes ancianos (>70 años), así como la cistectomía por vía abierta (debido a una herida quirúrgica más amplia) y la desnutrición postquirúrgica (niveles bajos de albúmina).
El periodo de mayor riesgo de infección de herida quirúrgica es en las primeras 72 horas después de la cirugía. Los síntomas incluyen enrojecimiento, hinchazón, dolor y aumento de la temperatura corporal. En casos graves, puede aparecer secreción purulenta o necrosis de los tejidos.
La infección de herida quirúrgica puede ser prevenida mediante la implementación de medidas de control de infecciones en el quirófano. La higiene adecuada de las manos del personal médico, la esterilización de los instrumentos quirúrgicos y la utilización de ropa de protección son medidas esenciales para prevenir la entrada de microorganismos en la herida quirúrgica. Además, la administración de antibióticos profilácticos antes de la cirugía y la limpieza de la zona quirúrgica con antisépticos son medidas efectivas para prevenir la infección de herida quirúrgica34.
El tratamiento de la infección de herida quirúrgica incluye la administración de antibióticos sistémicos y el tratamiento local de la herida quirúrgica con soluciones antisépticas y necesidad de drenaje de líquido seroso o hemático acumulado en el tejido celular subcutáneo. En casos graves, puede ser necesaria una revisión quirúrgica para desbridamiento, limpieza y cierre de herida quirúrgica35.
Las terapias basadas en presión negativa (NPWT) han mostrado su eficacia en el tratamiento de heridas crónicas, o en las dehiscencias de piel35. La NPWT incisional profiláctica es factible tras CR con una disminución discreta tanto de la ISQ como de las incidencias del sitio quirúrgico a los 90 días (ISQ + seroma + dehiscencia superficial), pero no de la tasa de reingresos. El cierre de heridas asistido por NPWT debe considerarse en los protocolos ERAS36.
Tabla 4. Resumen de series de CR y resultados del manejo de la infección de herida quirúrgica.
Figura 2. Algoritmo diagnóstico-terapéutico de la infección de herida quirúrgica tras cistectomía radical.
3.3 Complicaciones asociadas al estoma: retracción o necrosis del estoma
Las complicaciones asociadas al estoma se pueden dividir en dos grupos según complicaciones específicas del estomas (retracción, necrosis, hernia etcétera) o complicaciones cutáneas periestomales. La incidencia de ambos grupos se estima entre un 12 y un 72% según distintas series 40, siendo la necrosis y la retracción del estoma las más frecuentes, seguidas en menor medida por la hernia paraestomal, dado que esta, aunque más frecuente, suele diagnosticarse como complicación tardía.
Es importante estar atento a dichas complicaciones ya que representan uno de los factores que más puede alterar la calidad de vida de los pacientes tras la cirugía. Por ello, se recomienda una preparación adecuada del paciente prequirúrgica, mostrar especial atención durante la realización del estoma en la cirugía y seguimiento de dichos pacientes en una consulta especializada de enfermería con el fin de prevenir y manejar de forma precoz estas complicaciones 41.
Tabla 5. Resumen de series de CR y resultados del manejo de las complicaciones del estoma.
Tabla 6. Tabla-resumen del diagnóstico y tratamiento de los problemas asociados con el estoma tras la CR.
3.4 Obstrucción intestinal mecánica
La obstrucción intestinal mecánica es el principal diagnóstico diferencial con respecto al íleo paralítico (IP). La incidencia es globalmente es menor (1-9%), aunque en muchas revisiones se recoge de forma conjunta con el IP o en forma de complicaciones gastrointestinales 1. La principal causa son las adherencias o bridas postquirúrgicas, aunque en el caso concreto de derivación urinarias que impliquen segmentos intestinales, la creación de defectos mesentéricos puede derivar en una obstrucción intestinal secundaria a una hernia interna. Esta etiología se describe hasta en un 7% de las series 38. Otro punto de obstrucción mecánica puede ser a nivel de la anastomosis intestinal por deficiencia técnica al resultar estenótica, o secundariamente a una evisceración, vólvulo intestinal o hernia no reparada en la cirugía.
El proceso diagnóstico puede superponerse al del IP, e incluso en muchas ocasiones el cuadro obstructivo es consecuencia de otro proceso, como una dehiscencia anastomótica o una evisceración intestinal. Por ello, ante la sospecha de una obstrucción intestinal debemos realizar un estudio abdominal completo, incidiendo en la necesidad de valoración de la perfusión vascular intestinal y los datos asociados de sufrimiento intestinal 42. La prueba gold standard es la TC con contraste intravenoso, que además permite definir la localización de la obstrucción y proporciona datos de asa cerrada, isquemia intestinal o líquido libre; signos que habitualmente sugieren la necesidad de una intervención quirúrgica inmediata 43,44.
Una vez diagnosticada el origen mecánico del cuadro, el tratamiento dependerá de la causa, el estado del paciente y las posibilidades de resolución del cuadro con el tratamiento conservador. Los principios generales iniciales del tratamiento del IP son superponibles a este cuadro.
Generalmente, en los cuadros obstructivos por bridas, el éxito del tratamiento conservador es bastante alto (70-90%) 45. Aunque habitualmente se recomienda un periodo de máximo de 72 horas de observación, si no existe deterioro del estado general del paciente, normalidad en las pruebas complementarias y se ha asegurado un soporte nutricional, podría ser adecuado mantener una actitud expectante 46 , 47.
En caso de datos de sufrimiento intestinal, datos de asa cerrada o vólvulo intestinal 48, se recomienda cirugía urgente 42.
Tabla 7. Resumen de los principales estudios de manejo de obstrucción intestinal mecánica tras CR.
Figura 3. Algoritmo de manejo de obstrucción intestinal mecánica.
3.5 Dehiscencia de herida. Evisceración
La evisceración se define como la protrusión de las vísceras abdominales, generalmente epiplón e intestino delgado, debido a una dehiscencia de todos los planos de la pared abdominal después de una laparotomía 54. La incidencia es variable 0,4-3,5% y depende de varios factores relativos al tipo de cirugía o a las características del paciente 55,56. Dichos factores incluyen edad > 65 años, obesidad, infección de la herida, enfermedad pulmonar, hábito tabáquico, inestabilidad hemodinámica y ostomías en la incisión. Se identifican factores de riesgo similares para la dehiscencia de la herida y para las hernias incisionales 6.
La clínica es muy variable, pudiendo manifestarse como exteriorización de vísceras abdominales, salida de abundante líquido “en agua de lavar carne” por la herida quirúrgica o un cuadro obstructivo. Para el diagnóstico, en ocasiones la simple exploración física es diagnóstica. No obstante, en casos de duda se puede solicitar una TC para confirmar las sospechas.
El mejor tratamiento es la prevención con una adecuada técnica de cierre. Según la European Hernia Society se recomienda una sutura continua, con “small bites” con un hilo de reabsorción lenta. Además, en caso de cirugía laparoscópica se sugiere suturar el defecto fascial para trocares de ≥10 mm 57. Actualmente no existe evidencia para colocar mallas preventivas de forma rutinaria ni en la línea media ni en el estoma urinario 57,58.
En caso de evisceración clínica, el tratamiento definitivo es la reparación quirúrgica urgente y en estos pacientes el riesgo de morbi-mortalidad muy alto 59. Sin embargo, no existen unas recomendaciones estrictas sobre la técnica quirúrgica a realizar, aunque generalmente se sugiere seguir las mismas directrices que para el cierre primario 57,60. En los pacientes con alto riesgo de eventración futura podría ser adecuado colocar una malla de refuerzo. Esta malla podría colocarse en posición “onlay” (supraaponeurótica) o retromuscular. Sin embargo, este refuerzo no evitaría el riesgo de una nueva evisceración precoz postquirúrgica pero podría disminuir el riesgo de eventración futura 57.
Tabla 8. Resumen principales estudios de manejo de la evisceración tras CR.
Figura 4. Manejo de la evisceración tras CR.
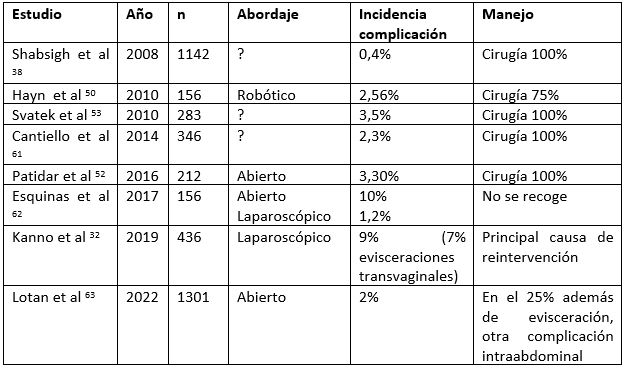
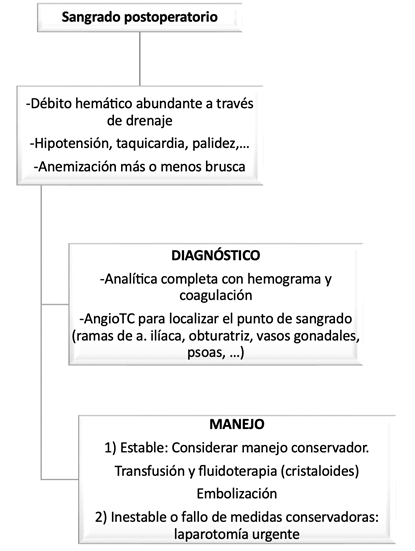
3.6 Sangrado postoperatorio. Hematoma
El sangrado significativo tras cistectomía es un evento raro, con una incidencia entre el 0,4% y el 5%. Las posibles causas de hemorragia postoperatoria en CR son generalmente: herida quirúrgica (plano cutáneo o subcutáneo), músculo (debido a sutura o paso de drenaje), lesión de vaso epigástrico al paso del drenaje, vasos en áreas de linfadenectomía (ilíaca, obturador,… debido a clips o ligadura desplazados), complejo de la vena dorsal, epiplón, anastomosis intestinal o ureterointestinal, mesenterio, tejidos blandos perirrectal, músculo psoas, o vasos gonadales64.
Ante un caso de sangrado postoperatorio, es fundamental decidir entre manejo conservador con transfusión sanguínea y aporte de volumen, con o sin necesidad de angioembolización, o bien, si fallan las medidas conservadoras o existe inestabilidad hemodinámica, reintervención urgente (laparotomía).
Tabla 9. Resumen de los estudios de sangrado postoperatorio.
Figura 5. Algoritmo diagnóstico-terapéutico del sangrado postoperatorio tras CR.
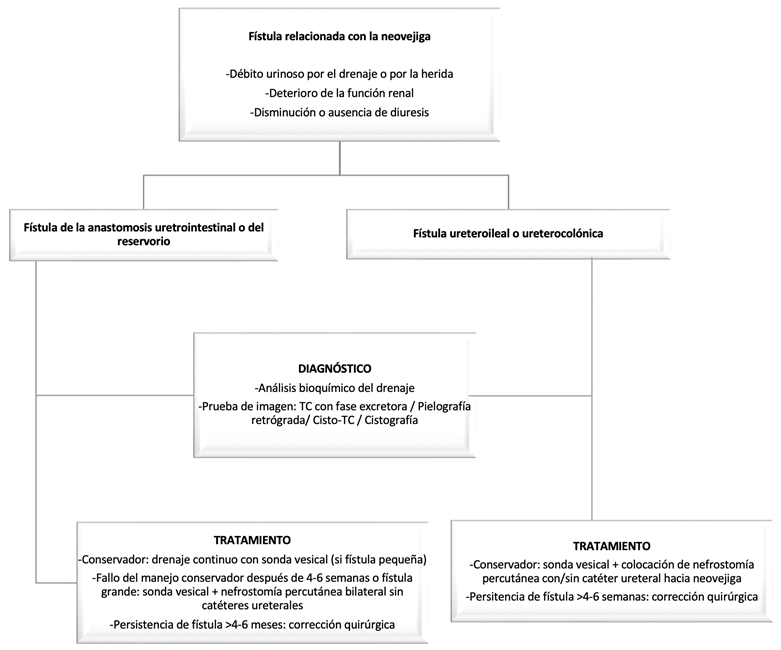
3.7 Fístula urinaria de la anastomosis ureterointestinal o del reservorio
La fístula de la anastomosis ureterointestinal ocurre principalmente dentro de los 7 días posteriores a la cirugía. Pocos estudios han demostrado que los factores perioperatorios, aparte de la técnica quirúrgica, se asocien con la incidencia de dicha complicación. El impacto de la radioterapia en la fuga urinaria tras la derivación urinaria sigue siendo controvertido 7.
La fístula urinaria por fuga de la anastomosis ureterointestinal o del reservorio/ conducto suelen presentarse con drenaje abundante (p. ej., >500ml de drenaje seroso o serohemático en un drenaje intraabdominal al final de la primera semana postquirúrgica 67), con creatinina sérica elevada, sepsis, salida de líquido de la herida, así como disminución de la diuresis. El aumento de la creatinina sérica se debe a la reabsorción de orina, íleo y distensión abdominal, o incluso peritonitis química. El diagnóstico de la fístula urinaria depende principalmente de los síntomas, las pruebas de laboratorio básicas y las pruebas de imagen (TC con fase excretora, pielografía, cistografía). La relación entre la concentración de creatinina en el líquido del drenaje y la concentración de creatinina sérica superior al 130 % es considerada un signo de fuga urinaria 7, con una sensibilidad para detectar las fugas urinarias de un cociente Cr en líquido:Cr sérica superior a 1,18 del 77,8% 67.
Una vez diagnosticada la fístula urinaria, el manejo inicial suele ser conservador, incluyendo la colocación de catéteres ureterales (si estos han sido ya retirados) y drenaje máximo del tracto urinario (con sonda vesical si se trata de una neovejiga y si es preciso, con nefrostomía percutánea). La mayoría de las fístulas ureterointestinales leves a moderadas pueden tratarse con éxito de forma conservadora con catéteres ureterales. Sin embargo, en caso de fuga persistente y abundante, o que no responda al tratamiento conservador durante 72 h, es necesario nefrostomía o reparación quirúrgica 7 , 68. Puede ser necesario el drenaje percutáneo si se ha producido la formación de urinoma de tamaño significativo 68.
Los catéteres en las neovejigas ortotópicas y las bolsas deben estar libres de acumulación de mucosidad, mientras que los catéteres ureterales pueden irrigarse si son externos 6. La necesidad de una sonda suprapúbica adicional para las sustituciones vesicales ortotópicas o la derivación tipo bolsa de Indiana, como mecanismo de seguridad en caso de que la sonda principal se obstruya es controvertida, con poca evidencia disponible.
La práctica más común consiste en dejar catéteres ureterales durante 10 días sin pielografía previa a su retirada, a menos que esté clínicamente indicado 6 , 68. No existe evidencia sobre cuánto tiempo se deben dejar colocados los drenajes y los catéteres, por lo que suele venir determinado por la preferencia y la experiencia del cirujano. Por ejemplo, en las neovejigas ortotópicas/ derivación continente, la sonda transuretral puede retirarse en 12 a 21 días sin reservoriograma/ cistografía, si el drenaje es mínimo (por ejemplo, 50 ml/día), mientras que otros cirujanos realizan reservogramas de rutina para detectar una fuga antes de la retirada de la sonda. El Memorial Sloan-Kettering Cancer Center incluso ha cuestionado el uso de catéteres ureterales en las reconstrucciones de CR 6.
Tabla 10. Resumen de los estudios de fístula urinaria.
Figura 6. Algoritmo diagnóstico-terapéutico de la fístula urinaria (de la unión ureterointestinal) tras cistectomía radical con derivación urinaria. *Se dividen en función de su detección antes o después de la retirada de los catéteres ureterales uniJ, que suele realizarse en el 10º día postoperatorio.
3.8 Fugas anastomóticas relacionadas con la neovejiga
Existe una variedad de técnicas quirúrgicas para la construcción de una neovejiga ortotópica. El íleon y la combinación de íleon y colon tienen las mejores propiedades fisiológicas para la derivación ortotópica, con uso de segmentos largos de intestino delgado destubularizado, a menudo de aproximadamente 60 a 75 cm, para crear un reservorio que permita acomodar 400 a 500 ml a baja presión 70. La anastomosis uretro-ileal puede ser realizada por vía laparoscópica o robótica, utilizando para ello una sutura barbada, o bien una sutura monofilamento reabsorbible 71.
Las fugas ureterales y de la neovejiga son complicaciones que se observan con mayor frecuencia en el período postoperatorio temprano, dentro de los primeros 60 días. La serie más larga de conductos incontinentes muestra que las tasas de fuga urinaria oscilan entre el 11-19%, lo que es comparable a lo publicado en series de casos de derivación continente, con tasas de fuga de aproximadamente el 15% 72.
La sospecha clínica de que existe una fístula de la neovejiga o de la anastomosis ureteral puede realizarse mediante determinación de creatinina en líquido de drenaje, o bien si el débito es a través de la herida quirúrgica (fístula neovejiga-cutánea) mediante la instilación retrógrada de azul de metileno en el reservorio. El uroTC es el método diagnóstico preferido, pudiendo también recurrir a la cistografía o cisto-TC, o bien a la pielografía anterógrada o retrógrada si tiene nefrostomía o catéter ureteral. Una vez que se ha confirmado la presencia de una fístula del a neovejiga, se puede tratar con drenaje continuo con sonda vesical, especialmente si es pequeña 72.
Si la fuga se debe a un defecto dentro del reservorio, se puede manejar inicialmente con el drenaje continuo de la neovejiga con sonda vesical. Si el drenaje simple continuo de la neovejiga falla después de 4 a 6 semanas o si se diagnostica una fístula de tamaño significativo, entonces, además del drenaje continuo con sonda, se puede optar por nefrostomía percutánea bilateral sin colocación de catéteres ureterales para derivar la orina. Se debe dar suficiente tiempo, hasta 4 a 6 meses, para permitir que la fístula cierre antes de considerar la corrección quirúrgica 72, salvo en casos de fuga importante probablemente secundaria a isquemia de segmento intestinal utilizado en la reconstrucción.
Si se diagnostica una fuga de la anastomosis ureterocolónica (uréter anastomosado a la bolsa) o ureteroileal, se coloca una nefrostomía percutánea con catéteres ureterales y drenaje continuo de la neovejiga con sonda. Se coloca un catéter de drenaje abdominal, si no está presente, para drenar los urinomas y evitar que la orina se acumule en el abdomen. Después de 4 a 6 semanas sin drenaje, se repiten las imágenes; si se ha resuelto la fuga, se retiran los catéteres. Si persiste una fuga o se encuentra una fuga importante, se debe valorar de forma individualizada la necesidad de intervención quirúrgica 72.
Figura 7. Algoritmo para el manejo de las fístulas urinarias relacionadas con la neovejiga: de la anastomosis uretra-neovejiga, del reservorio/defecto de la neovejiga, o de la anastomosis ureterointestinal.
3.9 Infección del sitio quirúrgico (ISQ). Absceso
La infección del sitio quirúrgico (ISQ, o SSI, por sus siglas en inglés) es la infección asociada a la atención médica más común después de la cirugía y se asocia con una morbimortalidad significativas, con tasas mayores de estancia hospitalaria y reingreso. La definición de ISQ de los Centros para el Control y la Prevención de Enfermedades (CDC) de los Estados Unidos es la más utilizada. Esta se define como una infección relacionada con un procedimiento quirúrgico que ocurre cerca del sitio quirúrgico dentro de los 30 días posteriores a la cirugía (o hasta 90 días posteriores a la cirugía si se trata de un implante). Las ISQ incisionales o de la herida se dividen, además, en aquellas que involucran solo la piel y los tejidos subcutáneos (ISQ incisional superficial) y las que involucran tejidos blandos más profundos de la incisión (ISQ incisional profunda). Las infecciones de órganos/espacios incluyen abscesos, fugas anastomóticas en cirugía intraabdominal e infecciones asociadas a implantes 73.
Las colecciones en el lecho quirúrgico se observan con relativa frecuencia en el postoperatorio precoz tras una CR. Los pacientes pueden presentar dolor abdominal, distensión, íleo o fiebre, así como alteración de parámetros analíticos (elevación de reactantes de fase aguda). El diagnóstico diferencial incluye urinomas, seromas, hematomas, linfoceles y abscesos. Entre éstos, los urinomas y los abscesos suelen requerir un drenaje percutáneo precoz 74.
La TAC con contraste (incluyendo fase excretora) es el estudio de elección para diferenciar estos tipos de colecciones líquidas. Si el diagnóstico es incierto, puede realizarse una aspiración con aguja para obtener material para análisis de laboratorio, incluyendo creatinina y pruebas de cultivo 75.
Tabla 11. Resumen de los estudios de la infección del sitio quirúrgico tras CR.
Figura 8. Algoritmo de manejo de las colecciones intraabdominales tras CR.
3.10 Drenaje linfático prolongado (linforrea). Linfocele
La linforrea se refiere al drenaje de líquido linfático que ocurre debido a la disección quirúrgica y al cierre inadecuado de los vasos linfáticos aferentes. Se suele dejar un drenaje peritoneal para evitar la formación de linfoceles.
Los linfoceles siguen siendo un problema en el postoperatorio de los pacientes sometidos a linfadenectomía pélvica, con tasas de linfoceles sintomáticos de entre el 1-3%. La mayoría de los linfoceles son asintomáticos y se resuelven espontáneamente, mientras que los linfoceles grandes o sintomáticos requieren drenaje percutáneo y rara vez se requiere cirugía abierta. Las indicaciones para tratamiento mediante drenaje o cirugía son: linfoceles grandes (~5 cm), sobreinfectados, o que se asocian con dolor o causan compresión de estructuras adyacentes (p. ej., uréter, vejiga urinaria, venas ilíacas) 64.
Tabla 12. Resumen de los estudios que contemplan la incidencia y/o manejo de linfoceles tras CR con linfadenectomía.
Figura 9. Algoritmo de diagnóstico y manejo del linfocele sintomático tras CR por cáncer vesical.
3.11 Dehiscencia de la anastomosis intestinal o fístula intestinal
No existe una definición única de dehiscencia y fuga anastomótica, aunque la mayoría de estudios incluyen en la definición: signos clínicos (dolor abdominal, fiebre, taquicardia, peritonitis, drenaje purulento o fecaloideo), hallazgos radiológicos (colecciones líquidas y/o con gas) y hallazgos intra-operatorios.
Tras una cistectomía, una fuga anastomótica ileo-ileal es rara y ocurre en 1 a 5% de los pacientes. Sin embargo, conlleva importante morbi-mortalidad 78. La fístula intestinal suele ocurrir entre el intestino y el tracto urinario reconstruido, o desde el intestino hacia el exterior (hacia la piel o cavidad abdominal).68
Para el diagnóstico, la TC con contraste oral e intravenoso es fundamental y una vez confirmada la fuga anastomótica, los pacientes deben recibir reanimación con sueroterapia y antibióticos de amplio espectro.
El tratamiento de una fuga anastomótica depende del estado clínico del paciente, de la naturaleza de la fuga y, si se realiza una laparotomía exploratoria, de los hallazgos intra-operatorios. Podemos estar ante diferentes escenarios 79 , 80:
- Una fuga subclínica, detectada radiológicamente en pacientes sin hallazgos abdominales clínicos. Este escenario puede manejarse de forma conservadora, aunque es una circunstancia poco frecuente en la clínica.
- Pacientes estables que presentan abscesos pequeños contenidos, se puede optar por un manejo inicial con antibióticos de amplio espectro, reposo intestinal y drenaje percutáneo.
- Los pacientes que presentan peritonitis generalizada o una fuga intraperitoneal libre deben ser revisados en quirófano y el manejo quirúrgico depende de los hallazgos intra-operatorios. Si el paciente se encuentra hemodinámicamente estable y el grado de contaminación no es elevado, se puede optar por rehacer la anastomosis. En cambio, en peritonitis extensas o pacientes inestables, puede ser necesario realizar una estoma digestivo terminal o de protección.
Tabla 13. Resumen de los principales estudios de manejo de la fístula anastomótica tras CR.
Figura 10. Algoritmo de diagnóstico y manejo de la fuga anastomótica.
Figura 11. Imágenes de complicaciones tras CR.
(a) TC, fases arterial y venosa. En lecho quirúrgico de linfadenectomía izquierda se objetiva extravasación de contraste en la fase arterial con aumento del extravasado en la fase venosa en relación con sangrado activo.
(b) TC, corte coronal. Probable hernia interna postquirúrgica (transmesentérica).
(c) TC, corte coronal. Neumatosis en pared de algunas asas y gas portal en probable relación a la sobredistensión de las asas intestinales. Se identifica cambio de calibre en FID y un arremolinamiento de vasos mesentéricos en íntima relación con el trayecto de los catéteres ureterales, que sugiere como etiología de la obstrucción una brida postquirúrgica vs hernia interna.
(d) UROTC, corte sagital. Coincidiendo con el paso del uréter izquierdo a través de la musculatura de la pared abdominal, se demuestra extravasado de contraste intramuscular que tiende a acumularse en el tejido celular subcutáneo y en los tabiques de los lobulillos grasos, formando pequeñas colecciones/urinomas, en relación con necrosis ureteral en paciente con ureterostomía cutánea bilateral.
(e) Cistografía que pone de manifiesto fístula en unión uretro-neovejiga en paciente con reconstrucción urinaria con neovejiga tipo Studer.
(f) Extravasación de contraste a nivel de la unión del ureter derecho y neovejiga que sugiere dehiscencia de la anastomosis.
(g) Sobreinfección y dehiscencia de herida quirúrgica (planos cutáneo y subcutáneo) en tercio inferior, con terapia de vacío.
(h) TC, topograma y corte axial. Dilatación de asas de intestino delgado, cámara gástrica y esófago, con contenido predominantemente líquido, en relación con íleo paralítico. Alguna pequeña burbuja de gas extraluminal cerca de la pared, de naturaleza postquirúrgica.
(i) TC, cortes axiales. Neumoperitoneo en cantidad llamativa que probablemente traduzca perforación intestinal, ya que existe una pequeña de colección con burbujas de gas adyacente a un asa ileal en mesogastrio, que se acompaña de dilatación de asas de delgado de hasta 4cm.
(j) Colección adyacente a psoas izquierdo de 10 cm de diámetro mayor (CC) que no se rellena de CIV en la fase excretora, con realce, compatible con linfocele sobreinfectado.
(k) TC, corte axial. Evisceración de asas de intestino delgado a través de laparotomía.
(l) TC abdominal de simulación. En la imagen izquierda, fuga de contraste pericatéter a la salida de estos a través de la neovejiga tipo bolsa de Indiana (reconstrucción vesical continente heterotópica). En la imagen derecha, drenaje TC-guiado de colección en gotiera parietocólica derecha sobreinfectada, secundaria a dicha fístula.
Referencias
- Maibom SL, Joensen UN, Poulsen AM, Kehlet H, Brasso K, Røder MA. Short-term morbidity and mortality following radical cystectomy: a systematic review. BMJ Open. 2021;11(4).
- Santoyo Vargas J, Castillo-Cobaleda D, García-Perdomo H. Aplicación del protocolo ERAS (Enhanced Recovery After Surgery) en cistectomía radical. Arch Españoles Urol. 2020;73(7):600–10.
- Sathianathen NJ, Kalapara A, Frydenberg M, Lawrentschuk N, Weight CJ, Parekh D, et al. Robotic Assisted Radical Cystectomy vs Open Radical Cystectomy: Systematic Review and Meta-Analysis. J Urol. 2019;201(4):715–20.
- Lisiński J, Kienitz J, Tousty P, Kaczmarek K, Lemiński A, Słojewski M. Comparison of Laparoscopic and Open Radical Cystectomy for Muscle-Invasive Bladder Cancer. Int J Environ Res Public Health. 2022;19(23).
- Feng D, Li A, Hu X, Lin T, Tang Y, Han P. Comparative effectiveness of open, laparoscopic and robot-assisted radical cystectomy for bladder cancer: a systematic review and network meta-analysis. Minerva Urol Nefrol. 2020;72(3):251–64.
- Lawrentschuk N, Colombo R, Hakenberg OW, Lerner SP, Månsson W, Sagalowsky A, et al. Prevention and management of complications following radical cystectomy for bladder cancer. Eur Urol. 2010;57(6):983–1001.
- Peng YL, Ning K, Wu ZS, Li ZY, Deng MH, Xiong L Bin, et al. Ureteral stents cannot decrease the incidence of ureteroileal anastomotic stricture and leakage: A systematic review and meta-analysis. Int J Surg. 2021;93:106058.
- Adnan S, Bakar MA, Khalil MAI, Fiaz S, Cheema ZA, Ali A, et al. Outcomes of Uretero-ileal Anastomosis in Bladder Cancer Cystectomies: Bricker vs. Wallace 1. Cureus. 2022;14(3).
- Davis NF, Burke JP, McDermott T, Flynn R, Manecksha RP, Thornhill JA. Bricker versus Wallace anastomosis: A meta-analysis of ureteroenteric stricture rates after ileal conduit urinary diversion. Can Urol Assoc J. 2015;9(5–6):E284.
- Zhang Y, Ding H, Zhang Y, Tian J, Yang L, Dong Z, et al. Is Anti-Reflux Anastomosis an Advantage in an Orthotopic Ileal Neobladder? A Systematic Review and Meta-Analysis. Urol Int. 2023;107(1):1–14.
- Touma N, Spodek J, Kuan J, Shepherd RR, Philip Hayman W, Chin JL. Confirming routine stentograms after cystectomy is unnecessary. Can Urol Assoc J. 2007;1(2):103–5.
- Vather R, Trivedi S, Bissett I. Defining Postoperative Ileus: Results of a Systematic Review and Global Survey. J Gastrointest Surg. 2013;17(5):962–72.
- Park HK, Kwak C, Byun S-S, Lee E, Lee SE. Early removal of nasogastric tube after cystectomy with urinary diversion: does postoperative ileus risk increase? Urology. 2005;65(5):905–8.
- Porpiglia F, Renard J, Billia M, Scoffone C, Cracco C, Terrone C, et al. Open versus laparoscopy-assisted radical cystectomy: results of a prospective study. J Endourol. 2007;21(3):325–9.
- Xue X, Wang D, Ji Z, Xie Y. Risk factors of postoperative ileus following laparoscopic radical cystectomy and developing a points-based risk assessment scale. Transl Androl Urol. 2021;10(6):2397–409.
- Forbes CM, Chehroudi AC, Mannas M, Bisaillon A, Hong T, So AI, et al. Defining postoperative ileus and associated risk factors in patients undergoing radical cystectomy with an Enhanced Recovery After Surgery (ERAS) program. Can Urol Assoc J = J l’Association des Urol du Canada. 2021;15(2):33–9.
- Sung LH, Yuk HD. Enhanced recovery after surgery of patients undergoing radical cystectomy for bladder cancer. Transl Androl Urol. 2021;9(6):2986–96.
- Ramirez JA, McIntosh AG, Strehlow R, Lawrence VA, Parekh DJ, Svatek RS. Definition, incidence, risk factors, and prevention of paralytic ileus following radical cystectomy: a systematic review. Eur Urol. 2013;64(4):588–97.
- Frager DH, Baer JW, Rothpearl A, Bossart PA. Distinction between postoperative ileus and mechanical small-bowel obstruction: value of CT compared with clinical and other radiographic findings. AJR Am J Roentgenol. 1995;164(4):891–4.
- Peck JJ, Milleson T, Phelan J. The role of computed tomography with contrast and small bowel follow-through in management of small bowel obstruction. Am J Surg. 1999;177(5):375–8.
- Lannes F, Walz J, Maubon T, Rybikowski S, Fakhfakh S, Picini M, et al. Enhanced Recovery after Surgery for Radical Cystectomy Decreases Postoperative Complications at Different Times. Urol Int. 2022;106(2):171–9.
- Peerbocus M, Wang ZJ. Enhanced recovery after surgery and radical cystectomy: A systematic review and meta-analysis. Res Reports Urol. 2021;13:535–47.
- García-Olmo D, Lima F. Íleo paralítico postoperatorio. Cirugía Española. 2001;69(3):89-94
- Kim SSY, MacNevin W, Rendon RA, Bell DG, Duplisea J, Bailly G, et al. Examining the impact of postoperative opioid use on length of hospital stay following radical cystectomy. Can Urol Assoc J = J l’Association des Urol du Canada. 2023;10.
- Biondo S, Miquel J, Espin-Basany E, Sanchez JL, Golda T, Ferrer-Artola AM, et al. A Double-Blinded Randomized Clinical Study on the Therapeutic Effect of Gastrografin® in Prolonged Postoperative Ileus After Elective Colorectal Surgery. World J Surg. 2016;40(1):206–14.
- Vather R, Josephson R, Jaung R, Kahokehr A, Sammour T, Bissett I. Gastrografin in Prolonged Postoperative Ileus: A Double-blinded Randomized Controlled Trial. Ann Surg. 2015;262(1):23–30.
- Choi H, Kang SH, Yoon DK, Kang SG, Ko HY, Moon DG, et al. Chewing gum has a stimulatory effect on bowel motility in patients after open or robotic radical cystectomy for bladder cancer: A prospective randomized comparative study. Urology. 2011;77(4):884–90.
- Takada N, Abe T, Shinohara N, Sazawa A, Maruyama S, Shinno Y, et al. Peri-operative morbidity and mortality related to radical cystectomy: a multi-institutional retrospective study in Japan. BJU Int. 2012;110: E756-E764
- Khan MS, Challacombe B, Elhage O, Rimington P, Coker B, Murphy D, et al. A dual-centre, cohort comparison of open, laparoscopic and robotic-assisted radical cystectomy. Int J Clin Pract. 2012;66(7):656-662.
- Sung HH, Ahn J-S, Seo S Il, Jeon SS, Choi HY, Lee HM, et al. A comparison of early complications between open and robot-assisted radical cystectomy. J Endourol. 2012;26(6):670–5.
- Hirobe M, Tanaka T, Shindo T, Ichihara K, Hotta H. Complications within 90 days after radical cystectomy for bladder cancer: results of a multicenter prospective study in Japan. Int J Clin Oncol. 2018;(0123456789).
- Kanno T, Ito K, Sawada A, Saito R, Kobayashi T, Yamada H, et al. Complications and reoperations after laparoscopic radical cystectomy in a Japanese multicenter cohort. Int J Urol. 2019;26(4):493-498.
- Meyer CP, Rios Diaz AJ, Dalela D, Hanske J, Pucheril D, Schmid M, et al. Wound dehiscence in a sample of 1 776 cystectomies: identification of predictors and implications for outcomes. BJU Int. 2016;117(6B):E95–101.
- Koie T, Yamamoto H, Okamoto A, Imai A, Iwabuchi I, Yoneyama T, Hashimoto Y, Momose A, Kamimura N, Ohyama C. Risk factors for surgical site infection in radical cystectomy: efficacy of buried suture by absorbable thread for skin closure. Hinyokika Kiyo. 2009 Feb;55(2):75-8
- Ocaña Jiménez J, Abadía Barno P, Ramos Rubio D, Pina Hernández JD, García Pérez JC, Moreno Montes I, et al. Papel de la terapia presión negativa en la prevención de infección del sitio quirúrgico en cirugía colorrectal. Cirugía Española. 2019;97(5):268–74.
- Joice GA, Tema G, Semerjian A, Gupta M, Bell M, Walker J, et al. Evaluation of Incisional Negative Pressure Wound Therapy in the Prevention of Surgical Site Occurrences After Radical Cystectomy: A New Addition to Enhanced Recovery After Surgery Protocol. Eur Urol Focus. 2020;6(4):698–703.
- Kulkarni JN, Pramesh CS, Rathi S, Pantvaidya GH. Long-term results of orthotopic neobladder reconstruction after radical cystectomy. BJU Int. 2003;91(6):485–8.
- Shabsigh A, Korets R, Vora KC, Brooks CM, Cronin AM, Savage C, et al. Defining Early Morbidity of Radical Cystectomy for Patients with Bladder Cancer Using a Standardized Reporting Methodology. Eur Urol. 2009;55(1):164–76.
- Nieuwenhuijzen JA, de Vries RR, Bex A, van der Poel HG, Meinhardt W, Antonini N, et al. Urinary diversions after cystectomy: the association of clinical factors, complications and functional results of four different diversions. Eur Urol. 2008;53(4):834–44.
- Salvadalena GD. The incidence of stoma and peristomal complications during the first 3 months after ostomy creation. J wound, ostomy, Cont Nurs Off Publ Wound, Ostomy Cont Nurses Soc. 2013;40(4):400–6.
- Herlufsen P, Olsen AG, Carlsen B, Nybaek H, Karlsmark T, Laursen TN, et al. Study of peristomal skin disorders in patients with permanent stomas. Br J Nurs. 2006;15(16):854–62.
- Broek RPG, Krielen P, Di Saverio S, Coccolini F, Biffl WL, Ansaloni L, et al. Bologna guidelines for diagnosis and management of adhesive small bowel obstruction (ASBO). World J Emerg Surg. 2018;13(1):13–24.
- Baghdadi YMK, Morris DS, Choudhry AJ, Thiels CA, Khasawneh MA, Polites SF, et al. Validation of the anatomic severity score developed by the American Association for the Surgery of Trauma in small bowel obstruction. J Surg Res. 2016;204(2):428–34.
- Zielinski MD, Eiken PW, Heller SF, Lohse CM, Huebner M, Sarr MG, et al. Prospective, observational validation of a multivariate small-bowel obstruction model to predict the need for operative intervention. J Am Coll Surg. 2011;212(6):1068–76.
- Blackwell RH, Kothari AN, Shah A, Gange W, Quek ML, Luchette FA, et al. Adhesive Bowel Obstruction Following Urologic Surgery: Improved Outcomes with Early Intervention. Curr Urol. 2018;11(4):175–81.
- Sakakibara T, Harada A, Yaguchi T, Koike M, Fujiwara M, Kodera Y, et al. The indicator for surgery in adhesive small bowel obstruction patient managed with long tube. Hepatogastroenterology. 2007;54(75):787–90.
- Keenan JE, Turley RS, McCoy CC, Migaly J, Shapiro ML, Scarborough JE. Trials of nonoperative management exceeding 3 days are associated with increased morbidity in patients undergoing surgery for uncomplicated adhesive small bowel obstruction. J Trauma Acute Care Surg. 2014;76(6):1367–72.
- Ataka R, Sato S, Matsubara K, Takagi M, Chihara I, Kohei N, Yoshimura K. Small bowel obstruction due to internal hernia caused by the ureter after laparoscopic radical cystectomy and ileal conduit: A case report. Asian J Endosc Surg. 2019 Apr;12(2):189-191.
- De Nunzio C, Cindolo L, Leonardo C, Antonelli A, Ceruti C, Franco G, et al. Analysis of radical cystectomy and urinary diversion complications with the Clavien classification system in an Italian real life cohort. Eur J Surg Oncol. 2013;39(7):792–8.
- Hayn MH, Hellenthal NJ, Hussain A, Stegemann AP, Guru KA. Defining morbidity of robot-assisted radical cystectomy using a standardized reporting methodology. Eur Urol. 2011;59(2):213–8.
- Nazmy M, Yuh B, Kawachi M, Lau CS, Linehan J, Ruel NH, et al. Early and late complications of robot-assisted radical cystectomy: A Standardized analysis by urinary diversion type. J Urol. 2014;191(3):681–7.
- Patidar N, Yadav P, Sureka SK, Mittal V, Kapoor R, Mandhani A. An audit of early complications of radical cystectomy using Clavien-Dindo classification. Indian J Urol. 2016;32(4):282–7.
- Svatek RS, Fisher MB, Matin SF, Kamat AM, Grossman HB, Nogueras-González GM, et al. Risk Factor Analysis in a Contemporary Cystectomy Cohort Using Standardized Reporting Methodology and Adverse Event Criteria. J Urol. 2010;183(3):929–34.
- Lobato JL, Andia D, Gorostiaga A, López-Valverde M. Dehiscencia de la pared abdominal y evisceración en cirugía ginecológica. Clin Invest Ginecol Obstet. 2010;37(2):53–5.
- Van Ramshorst GH, Nieuwenhuizen J, Hop WCJ, Arends P, Boom J, Jeekel J, et al. Abdominal wound dehiscence in adults: development and validation of a risk model. World J Surg. 2010;34(1):20–7.
- Carlson MA. Acute wound failure. Surg Clin North Am. 1997;77(3):607–36.
- Deerenberg EB, Henriksen NA, Antoniou GA, Antoniou SA, Bramer WM, Fischer JP, et al. Updated guideline for closure of abdominal wall incisions from the European and American Hernia Societies. Br J Surg. 2022;109(12):1239–50.
- Simons MP, Smietanski M, Bonjer HJ, Bittner R, Miserez M, Aufenacker TJ, et al. Directrices sobre la prevención y tratamiento de hernias paraestomales. Www.europeanherniasociety.eu
- Van Ramshorst GH, Nieuwenhuizen J, Hop WCJ, Arends P, Boom J, Jeekel J, et al. Abdominal wound dehiscence in adults: Development and validation of a risk model. World J Surg. 2010;34(1):20–7.
- Millbourn D, Cengiz Y, Israelsson LA. Effect of stitch length on wound complications after closure of midline incisions: a randomized controlled trial. Arch Surg. 2009;144(11):1056–9.
- Cantiello F, Cicione A, Autorino R, De Nunzio C, Salonia A, Briganti A, et al. Metabolic syndrome, obesity, and radical cystectomy complications: A clavien classification system-based analysis. Clin Genitourin Cancer. 2014;12(5):384–93.
- Esquinas C, Alonso JM, Mateo E, Dotor A, Martín AM, Dorado JF, et al. Estudio prospectivo comparativo entre cistectomía radical laparoscópica y abierta: resultados operatorios y oncológicos. Actas Urol Esp. 2018;42(2):94–102.
- Lotan P, Bercovich S, Keidar D, Malshy K, Savin Z, Haramaty R, et al. Fascial dehiscence after radical cystectomy: Is abdominal exploration mandatory? BMC Urol. 2022;22(1):1–7.
- Bearbeitet von. Markus Hohenfellner, R.A. Santucci. Emergencies in Urology. Auflage 2007. Buch. xxviii, 659 S. Hardcover. ISBN 978 3 540 48603 9. Chapter 18.1 Acute postoperative complications. Seitz M, Schlenker B, Stief C.
- Novotny V, Hakenberg OW, Wiessner D, Heberling U, Litz RJ, Oehlschlaeger S, et al. Perioperative Complications of Radical Cystectomy in a Contemporary Series. Eur Urol. 2007;51(2):397–402.
- Catto JWF, Khetrapal P, Ricciardi F, Ambler G, Williams NR, Al-Hammouri T, et al. Effect of Robot-Assisted Radical Cystectomy With Intracorporeal Urinary Diversion vs Open Radical Cystectomy on 90-Day Morbidity and Mortality Among Patients With Bladder Cancer: A Randomized Clinical Trial. JAMA. 2022;327(21):2092.
- Regmi S, Bearrick E, Hannah P, Sathianathen N, Kalapara A, Konety B. Drain fluid creatinine-to-serum creatinine ratio as an initial test to detect urine leakage following cystectomy: A retrospective study. Indian J Urol. 2021;37(2):153.
- Rodríguez Faba O, Parada Moreno R, Malca L, Palomino Martínez A, Nervo N, Breda A, et al. Postoperative management of radical cystectomy. Review of the evidence on the prevention and treatment of urological complications. Actas Urol Esp. 2018;42(3):143–51.
- Shao P, Li P, Ju X, Qin C, Li J, Lv Q, et al. Laparoscopic radical cystectomy with intracorporeal orthotopic ileal neobladder: technique and clinical outcomes. Urology. 2015;85(2):368–74.
- Niederhuber J, O. Armitage J, Doroshow J. 2019. Abeloff’s Clinical Oncology.
- Almassi N, Zargar H, Ganesan V, Fergany A, Haber GP. Management of Challenging Urethro-ileal Anastomosis During Robotic Assisted Radical Cystectomy with Intracorporeal Neobladder Formation. Eur Urol. 2016;69(4):704–9.
- Ramirez P, Frumovitz M, R Abu-Rustum N. 2019. Principles of Gynecologic Oncology Surgery.
- Overview of the evaluation and management of surgical site infection – UpToDate. Available from: https://www.uptodate.com/contents/overview-of-the-evaluation-and-management-of-surgical-site-infection/print
- Pariser JJ, Anderson BB, Pearce SM, Han Z, Rodriguez JA, Landon E, et al. The effect of broader, directed antimicrobial prophylaxis including fungal coverage on perioperative infectious complications after radical cystectomy. Urol Oncol. 2016;34(3):121.e9-121.e14.
- Thornton RH, Covey AM. Urinary Drainage Procedures in Interventional Radiology. Tech Vasc Interv Radiol. 2016;19(3):170–81.
- Chahal R, Sundaram SK, Iddenden R, Forman DF, Weston PMT, Harrison SCW. A study of the morbidity, mortality and long-term survival following radical cystectomy and radical radiotherapy in the treatment of invasive bladder cancer in Yorkshire. Eur Urol. 2003;43(3):246–57.
- Arumainayagam N, McGrath J, Jefferson KP, Gillatt DA. Introduction of an enhanced recovery protocol for radical cystectomy. BJU Int. 2008;101(6):698–701.
- Gabriel P, Siebert M, Le Fouler A, Van Glabeke E, Trésallet C. Management of gastro-intestinal emergencies in patients with ileal conduit ureteral diversion. J Visc Surg. 2022;159(5):399–408.
- Phitayakorn R, Delaney CP, Reynolds HL, Champagne BJ, Heriot AG, Neary P, et al. Standardized algorithms for management of anastomotic leaks and related abdominal and pelvic abscesses after colorectal surgery. World J Surg. 2008;32(6):1147–56.
- Anderson CB, McKiernan JM. Surgical Complications of Urinary Diversion. Urol Clin North Am. 2018;45(1):79–90.
- Albisinni S, Oderda M, Fossion L, Varca V, Rassweiler J, Cathelineau X, et al. The morbidity of laparoscopic radical cystectomy: analysis of postoperative complications in a multicenter cohort by the European Association of Urology (EAU)-Section of Uro-Technology. World J Urol. 2016;34(2):149–56.